-
下列说法正确的是
A.非自发反应一定不能实现
B.同种物质气态时熵值最小,固态时熵值最大
C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H <0
D.恒温恒压下,△H <0且△S>0的反应一定不能自发进行
难度: 简单查看答案及解析
-
可逆反应3Fe(s))+4H2O(g)= Fe3O4(s)+4H2(g)在容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.保持容器体积不变,加入水蒸气
B.将容器的容积缩小一半
C.保持容器容积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使体系容积增大
难度: 简单查看答案及解析
-
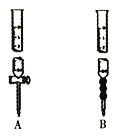
下列反应符合如图所示的反应是( )

A.金属钠与水的反应
B.氢气燃烧
C.浓硫酸的稀释
D.Ba(OH)2•8H2O和NH4Cl (固体)混合
难度: 简单查看答案及解析
-
对已达到化学平衡的反应2X(g)+Y(g)
2Z(g),减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.将NaOH和氨水各稀释一倍,两者的OH-浓度均减少到原来的二分之一
C.如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
D.中和等体积、等物质的量浓度的盐酸和醋酸溶液,两者所需要的氢氧化钠一样多
难度: 简单查看答案及解析
-
物质的量浓度相同的NaX、NaY和NaZ溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX,HZ, HY B.HX,HY,HZ C.HZ,HY,HX D.HY,HZ,HX
难度: 简单查看答案及解析
-
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是( )。
A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
难度: 简单查看答案及解析
-
化学与生产、生活密切相关。下列说法不正确的是( )
A.除去废水中的Cu2+、Ag+等重金属离子可选用Na2S溶液
B.保存FeCl3溶液时,通常在溶液中加少量的单质铁
C.检查消化系统使用“钡餐”的成分是硫酸钡
D.除去水垢中的CaSO4常用试剂有碳酸钠和盐酸
难度: 简单查看答案及解析
-
已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1L 0.1mol/L 稀盐酸中含HCl分子的数目为0.1NA
B.0.1mol/L磷酸钠溶液中PO
数目小于0.1NA
C.25℃,1L pH=1的H3PO4溶液中,水电离产生的OH- 数目为10-13 NA
D.0.1 L 0.5 mol/L CH3COOH溶液中含有的H+数为0.05NA
难度: 中等查看答案及解析
-
下列说法或表示法不正确的是( )
A.1mol硫蒸气与2mol硫蒸气完全燃烧时,燃烧热相同
B.已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1,则H2的燃烧热为285.8kJ·mol-1
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(aq)△H=-57.3kJ·mol-1,若将含1molCH3COOH的稀醋酸溶液与含1molBa(OH)2的稀溶液混合,放出的热量小于57.3kJ
D.已知Ⅰ:反应H2(g)+Cl2(g)=2HCl(g) △H=-akJ/mol;Ⅱ:
 ,
,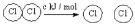 ,且a、b、c均大于零,则断开1mol H-Cl键所需的能量为2(a-b-c) kJ/mol
,且a、b、c均大于零,则断开1mol H-Cl键所需的能量为2(a-b-c) kJ/mol难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符合的是
A.
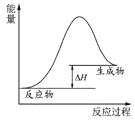 表示燃料燃烧反应的能量变化
表示燃料燃烧反应的能量变化B.
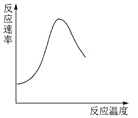 表示酶催化反应的反应速率随反应温度的变化
表示酶催化反应的反应速率随反应温度的变化C.
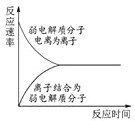 表示弱电解质在水中建立电离平衡的过程
表示弱电解质在水中建立电离平衡的过程D.
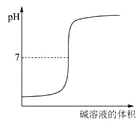 表示强碱滴定强酸的滴定曲线
表示强碱滴定强酸的滴定曲线难度: 中等查看答案及解析
-
下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
难度: 中等查看答案及解析
-
煤的工业加工过程中,可利用CO和H2合成甲醇,能量变化如图所示。下列说法正确的是
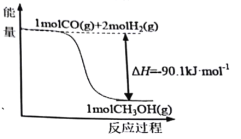
A.该反应是吸热反应
B.1molCH3OH所具有的能量为90.1kJ
C.CO(g)+2H2(g)
CH3OH(l) ΔH=-90.1kJ·mol-1
D.1molCO和2molH2断键所需能量小于1molCH3OH断键所需能量
难度: 中等查看答案及解析
-
可逆反应mA(固)+nB(气)
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
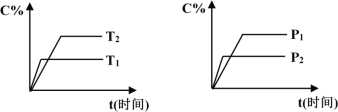
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
难度: 简单查看答案及解析
-
室温下进行下列实验,根据实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向5 mL 0.1 mol·L-1 KI溶液中加入0.1mol·L-1 FeCl3溶液1 mL,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液,出现血红色
反应Fe3++I-→Fe2++I2是有一定限度的
B
向滴有酚酞的1mL 0.1mol·L-1K2CO3溶液中加水稀释至10mL,红色变浅
加水稀释时,CO32-的水解平衡向逆反应方向移动
C
用Zn和稀硫酸反应制取氢气,向反应液中滴入几滴CuSO4溶液,产生气泡的速率明显加快
Cu2+是反应的催化剂
D
向AgI悬浊液中滴加NaCl溶液,不出现白色沉淀
更难溶的物质无法转化为难溶的物质
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
某温度下,可逆反应mA(g)+nB(g)
pC(g)的平衡常数为K,下列对K的说法正确的是
A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
难度: 简单查看答案及解析
-
室温下,下列操作可以使0.01 mol·L-1 NH3·H2O溶液中c(NH
)增大的是( )
A.加入少量H2O B.加入少量NaOH固体
C.通入少量HCl气体 D.降低温度
难度: 简单查看答案及解析
-
常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4溶液pH约为7。

下列说法正确的是( )
A.实验①滴加过程中溶液所有离子浓度都减小
B.实验②滴至pH=2时,溶液中c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C.实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+)
D.滴定结束后,①中水的电离程度比②中大
难度: 中等查看答案及解析
-
已知:4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) ΔH=-1200 kJ·mol−1。在2 L恒容密闭容器中,按照下表中甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%。下列说法中正确的是
甲
乙
0.2 mol NO2
0.1 mol NO2
0.4 mol CO
0.2 mol CO
A.放热反应,一定能自发进行
B.该温度下,反应的平衡常数为5
C.达平衡时,NO2的浓度:甲>乙
D.达平衡时,N2的体积分数:甲<乙
难度: 中等查看答案及解析
-
下列有关说法中不正确的是( )
A.某温度时的混合溶液中c(H+) =
mol·L-1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.常温下,由水电离出的c(H+)=10-12mol·L-1的溶液的pH可能为2或12
C.常温下,pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)>c(OH-)
D.常温下pH=7的CH3COOH和CH3COONa混合溶液中,c(Na+)=c(CH3COO-)+c(CH3COOH)
难度: 中等查看答案及解析