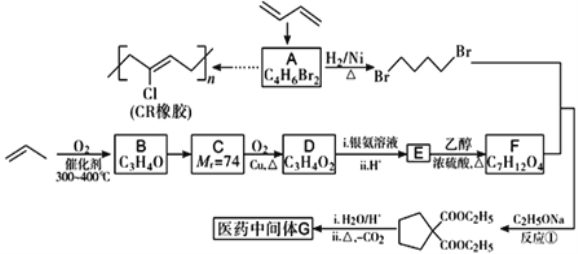
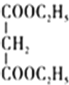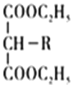-
《周礼)记载“煤饼烧砺(贝壳)成灰”,并把这种灰称为“蜃”,古人蔡伦以“蜃”改进了造纸术。下列说法错误的是
A. 贝壳的主要成分CaCO3 B. “砺成灰”是氧化还原反应
C. “蜃”与水混合,溶液呈碱性 D. 纸张主要成分是纤维素
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A. 25℃,pH=13的Ba(OH)2溶液中OH-数目为0.1NA
B. 常温常压下,22.4L Cl2和5.6gFe充分反应转移电子数目为0.3 NA
C. 8.0gCu2S和CuO的混合物中所含的铜原子数为0.1 NA
D. 标准状况下,5.6L乙烷中含有的极性键数目为1.5NA
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
向某溶液中加H2O2 溶液,滴加KSCN溶液
溶液变成血红色
原溶液中一定含有Fe2+
B
向H2S 溶液通入O2
溶液变浑浊
氧化性:O2>S
C
先等浓度的碳酸氢钠溶液和碳酸钠溶液分别滴加2滴酚酞溶液
后者红色更深
水解程度:碳酸氢钠>碳酸钠
D
向1mol/LNa2S溶液中滴加0.1mol/LZnSO4 溶液制不再产生沉淀,继续滴加0.1mol/LCuSO4溶液
白色沉淀转化为黑色
Ksp(CuS)>Ksp(ZnS)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明溶液中:K+、MnO4-、Cl-、H+
B. c(OH-)/c(H+)=10-12的溶液中:Na+、K+、NO3-、ClO-
C. pH=12 的无色溶液:K+、Na+、CH3COO-、Br-
D. 含Na2SO3 的溶液中:K+、H+、Cl-、NO3-
难度: 中等查看答案及解析
-
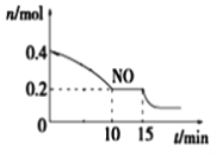
短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
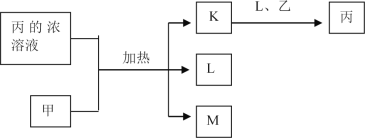
A.原子半径:W<X<Y B.元素的非全属性:Z>Y>X
C.化合物XYZ中只含共价键 D.K、L、M中沸点最高的是M
难度: 困难查看答案及解析
-
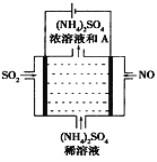
某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为
],酸液室通入
(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述正确的是 ( )
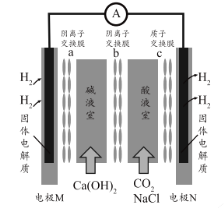
A.电子由N极经外电路流向M极
B.N电极区的电极反应式为
↑
C.在碱液室可以生成
D.放电一段时间后,酸液室溶液pH减小
难度: 中等查看答案及解析
-
常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
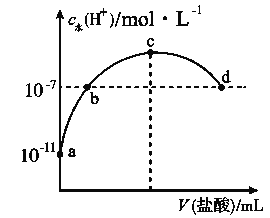
A. 常温下,0.1 mol·L-1氨水中
的电离常数
约为
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
难度: 中等查看答案及解析
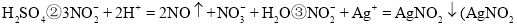 为淡黄色接近白色固体,在水中形成沉淀
为淡黄色接近白色固体,在水中形成沉淀
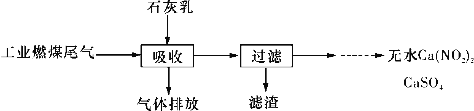
 的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值。(结果保留一位小数)(要求写出计算过程)。____________
的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值。(结果保留一位小数)(要求写出计算过程)。____________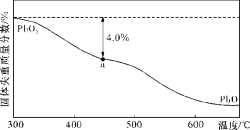 。
。