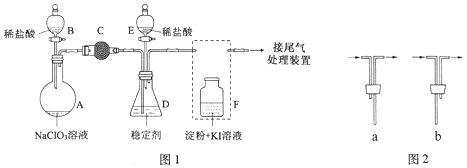
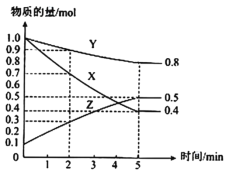
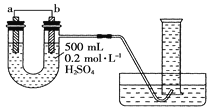
-
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2↑,下列有关说法正确的是( )
A.锂电极作电池负极,放电过程中发生还原反应
B.1 mol SOCl2发生电极反应转移的电子物质的量为4 mol
C.组装该电池必须在无水、无氧的条件下进行
D.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2 ↑
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W是地壳中含量最高的元素,X的原子半径是所有短周期主族元素中最大的,非金属元素Y的原子序数是Z的最外层电子数的2倍。下列叙述不正确的是
A.Y单质的熔点高于X单质 B.W、Z的氢化物沸点W>Z
C.X、W、Z能形成具有强还原性的XZW D.X2YW3中含有共价键
难度: 中等查看答案及解析
-
2019年4月22日是第50个“世界地球日”,我国确定的活动主题为“珍爱美丽地球,守护自然资源”。下列行为不符合今这一活动主题的是
A. 积极推进“煤改气”等改造工程
B. 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用
C. 研制开发燃料电池汽车,消除机动车尾气污染
D. 实施秸秆禁烧,增加化石燃料的供应量
难度: 简单查看答案及解析
-
下列对实验操作分析错误的是
A.配制0.1mol/LNaCl溶液时,若没有洗涤烧杯和玻璃棒,则所得溶液物质的量浓度偏低
B.NH4NO3溶解吸热,若配制0.5mol/L NH4NO3溶液时直接将溶解后的溶液转移到容量瓶中,则所得溶液的物质的量浓度偏高
C.配制一定物质的量浓度溶液时,若所用砝码已经生锈,则所得溶液的物质的量浓度偏高
D.配制一定物质的量浓度溶液时,若定容中不小心加水超过刻度线,立刻将超出的水吸出,则所得溶液的物质的量浓度偏低
难度: 中等查看答案及解析
-
已知:5PbO2+2 Mn2++4H+=5Pb2++2MnO4-+2H2O,下列说法正确的是( )
A.PbO2为还原剂,具有还原性
B.氧化产物与还原产物的物质的量之比为5:2
C.生成1 mol的Pb2+,转移的电子数为 5 mol
D.酸性环境下PbO2 的氧化性强于的MnO4-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.0.1mol丙烷中含有的非极性键数为0.3NA
B.64gSO2和16gO2充分反应,生成SO3的分子数为NA
C.标准状况下,2.24L四氯化碳中所含分子数为0.1NA
D.1mol乙烷所含电子数为18NA
难度: 中等查看答案及解析
-
在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)
2Z(g),此反应达到平衡的标志是( )
A. 单位时间内消耗0.1 mol X的同时生成0.2 mol Z
B. v正(X) =v逆(Z)
C. 容器内X、Y、Z的浓度之比为1∶2∶2
D. 容器内压强不随时间变化
难度: 中等查看答案及解析
-
下列关于丙烷结构、性质的推断中正确的是( )。
A.丙烷能使溴水、酸性KMnO4溶液都褪色
B.丙烷可与氯水发生取代反应
C.丙烷的3个碳原子不在同一直线上
D.丙烷可与强酸或强碱反应
难度: 简单查看答案及解析