-
化学与生活密切相关。下列说法错误的是
A.泡沫灭火器可用于一般的灭火,也适用于电器灭火
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
下列表示不正确的是 ( )
A.次氯酸的电子式:
B.丁烷的球棍模型:
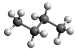
C.乙烯的结构简式:CH2=CH2 D.原子核内有8个中子的碳原子:
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是 ( )
A.常温常压下,124gP4中所含P-P键数目为4NA
B.1L0.1mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
C.92.0g甘油(丙三醇)中含有羟基数为1.0NA
D.amol的R2+(R的核内中子数为N,质量数为A)的核外电子数为a(A-N-2)NA
难度: 中等查看答案及解析
-
下列化学用语对事实的表述不正确的是( )
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O
NH4++OH−
C. 由Na和C1形成离子键的过程:

D. 电解精炼铜的阴极反应:Cu2+ +2e−=Cu
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是 ( )
A.

B.
C.
D.
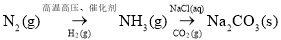
难度: 中等查看答案及解析
-
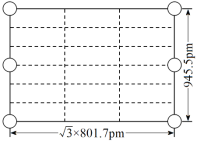
如图是一种新型离子化合物,该物质由两种阳离子和两种阴离子构成,其中有一种18电子离子和两种10电子离子。W、X、Y、Z均为短周期元素,且均不在同一主族。下列说法不正确的是( )
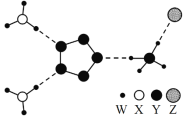
A.X与W形成的简单化合物沸点高于X同族元素与W形成的简单化合物的沸点
B.Z的最高价氧化物对应水化物的酸性比Y的强
C.Y气态氢化物的稳定性比X的强
D.如图化合物中,存在极性共价键和非极性共价键
难度: 中等查看答案及解析
-
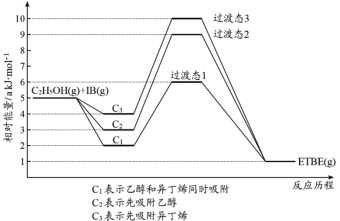
2019年9月,我国科研人员研制出Ti-H-Fe双温区催化剂,其中Ti-H区域和Fe区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是 ( )

A.①②③在高温区发生,④⑤在低温区发生
B.该历程中能量变化最大的是2.46eV,是氮分子中氮氮三键的断裂过程
C.在高温区加快了反应速率,低温区提高了氨的产率
D.使用Ti-H-Fe双温区催化合成氨,不会改变合成氨反应的反应热
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.H2(g)+I2(g)⇌2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g)⇌H2(g)+CO(g),碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g)⇌2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2不等于Q1
难度: 中等查看答案及解析
-
室温下进行下列实验,根据实验操作和现象所得到的结论正确的是 ( )
实验操作和现象
结论
A
向淀粉溶液中滴加稀H2SO4并加热,冷却后滴入银氨溶液,水浴加热,未产生银镜
淀粉未水解
B
向4mL0.5mol·L−1的KMnO4溶液中滴加2mL浓度分别为0.01mol·L−1、0.05mol·L−1的H2C2O4溶液,后一支试管先褪色
其它条件相同时,浓度越大,化学反应速率越大
C
向3mLKI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理,实验时关闭图1中的a,用单孔塞(插有吸入水的胶头滴管)塞紧颈口c,将水挤入三颈烧瓶中,打开b,完成喷泉实验。电脑绘制三颈烧瓶内压强变化曲线图2。下列说法正确的是 ( )
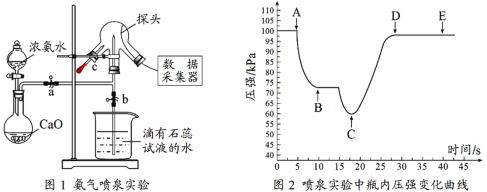
A.干燥氨气通常可选用浓硫酸 B.三颈烧瓶内可以看到红色喷泉
C.图1中氧化钙可用氯化钙代替 D.由图2可知C点时喷泉最剧烈
难度: 简单查看答案及解析
-
扎那米韦(其结构如图所示)可用于治疗由病毒感染引起的疾病。下列关于扎那米韦的说法正确的是( )
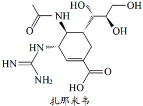
A.能与蛋白质形成分子间氢键
B.不能使溴的四氯化碳溶液褪色
C.在一定条件下能水解生成乙醇
D.分子中的羟基不能被氧化为羧基
难度: 简单查看答案及解析
-
电解法处理CO2和SO2的混合气体的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( )
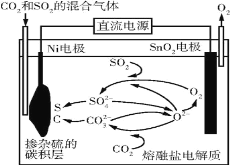
A.Ni电极表面发生了还原反应
B.阳极的电极反应为2O2--4e-=O2↑
C.电解质中发生的离子反应只有2SO2+O2+2O2-=2SO
D.该过程实现了电解质中熔融碳酸盐和硫酸盐的自主补充循环
难度: 中等查看答案及解析
-
常温时,向120 mL 0.005 mol·L-1 CaCl2溶液中逐滴加入0.1 mol·L-1 Na2CO3溶液,混合溶液的电导率变化曲线如图所示。已知25℃时,Ksp(CaCO3)=3.36×10-9,忽略CO32-水解。下列说法正确的是( )
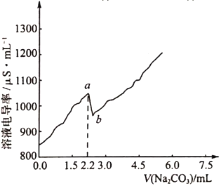
A.a点对应的溶液中Ca2+开始形成沉淀,且溶液中c(Ca2+)=c(CO32-)
B.b点对应的溶液中Ca2+已完全沉淀,且存在关系:c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.如图可以说明CaCO3在溶液中存在过饱和现象
D.在滴加Na2CO3溶液的过程中,混合溶液的pH先减小后增大
难度: 困难查看答案及解析
-
工业上常用(NH4)2SO3溶液吸收废气中的SO2,室温下测得溶液中lgY[Y=
或
],与pH的变化关系如图所示。则下列说法一定错误的是( )
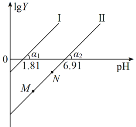
A.通入少量SO2的过程中,直线Ⅱ中的N点向M点移动
B.α1=α2一定等于45°
C.直线Ⅱ中M、N点一定存在c2(HSO
)>c(SO
)·c(H2SO3)
D.当对应溶液的pH处于1.81<pH<6.91时,溶液中的一定存在:c(HSO
)>c(SO
)>c(H2SO3)
难度: 困难查看答案及解析
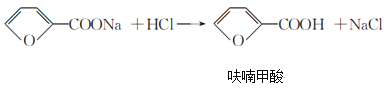
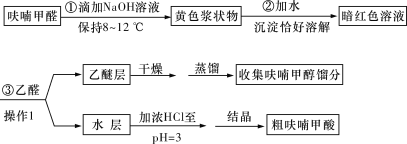
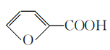 )俗名糠酸,其在塑料工业中可用作增塑剂、热固性树脂等,在食品工业中可用作防腐剂,也可用作涂料添加剂、医药。呋喃甲酸可由呋喃甲醛制备,其制备原理如下所示:
)俗名糠酸,其在塑料工业中可用作增塑剂、热固性树脂等,在食品工业中可用作防腐剂,也可用作涂料添加剂、医药。呋喃甲酸可由呋喃甲醛制备,其制备原理如下所示: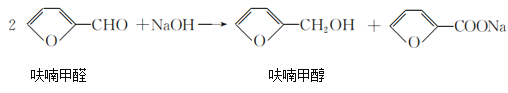
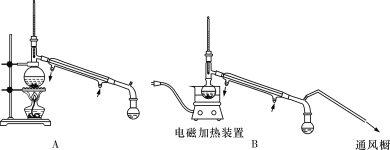

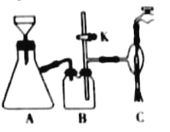

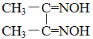 ,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。
,简写为C4N2H8O2)能和Ni2+反应生产鲜红色的沉淀,其方程式为:Ni2++2C4N2H8O2+2NH3·H2O=Ni(C4N2H7O2)2↓+2NH4++2H2O,Ni(C4N2H7O2)2的摩尔质量为289g/mol]。Ni2+能与CO32-、C2O42-、S2-等离子形成沉淀,但为什么很多情况下选用丁二酮肟有机沉淀剂?___。