-
叶蜡石是一种重要的化工原料,化学式为X2[Y4Z10](ZW)2,短周期元素W、Z、X、Y的原子序数依次增大,Y的最外层电子数为次外层的一半,X为地壳中含量最多的金属元素,X的离子与ZW-含有相同的电子数。下列说法不正确的是
A.原子半径:X>Y>Z>W B.最简单氢化物的沸点:Y>Z
C.Y的氧化物可作光导纤维的材料 D.常温常压下,Z和W形成的常见化合物均为液体
难度: 简单查看答案及解析
-
成语、古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是
选项
传统文化
化学角度解读
A
兰陵美酒郁金香,玉碗盛来琥珀光
“香”主要因为美酒含有酯类物质
B
百炼成钢、钢筋铁骨
生铁在高温下挥发除去碳等杂质转化成钢
C
三月打雷麦谷堆
在雷电作用下N2转化成能被作物吸收的氮元素
D
《本草经集注》记载“如握盐雪不冰,强烧之,紫青烟起…云是真硝石也”
利用物理方法(焰色反应)可以检验钠盐和钾盐
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
NA是阿伏加德罗常数的值。下列说法正确的是
A.0.5 molN4(分子为正四面体结构)含共价键数目为2NA
B.1 L 0.5 mol·L1 Na2S溶液中含阴离子数目小于0.5NA
C.锌与浓硫酸反应生成气体11.2 L(标准状况)时转移电子数目为NA
D.14 g己烯和环己烷的混合物含氢原子数目为3NA
难度: 中等查看答案及解析
-
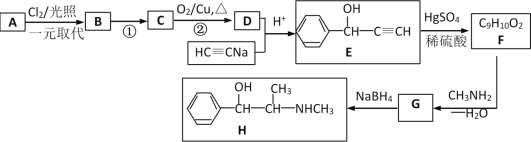
下列说法正确的是
A.戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯
B.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种
C.将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2
D.
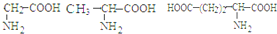 三种氨基酸脱水,最多可生成6种二肽
三种氨基酸脱水,最多可生成6种二肽难度: 中等查看答案及解析
-
类比推理是化学中常用的思维方法。下列推理正确的是
A.铝丝与硫酸铜溶液反应可看到“铜树”,推测镁带与硫酸铜溶液反应可看到“铜树”
B.CO2是直线型分子,推测CS2也是直线型分子
C.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3
D.能用NaBr固体与浓硫酸共热制备HBr,推测能用KI固体与浓硫酸共热制备HI
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.CH3—CH=CH2和CH2=CH2的最简式相同
B.
与
互为同系物
C.下列物质的沸点按由低到高顺序为:(CH3) 2CHCH3<(CH3) 4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3
D.等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小
难度: 简单查看答案及解析
-
下列关于有机化合物M和N的说法正确的是
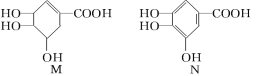
A.等物质的量的两种物质跟足量的NaOH反应,消耗NaOH的量相等
B.完全燃烧等物质的量的两种物质生成二氧化碳和水的量分别相等
C.一定条件下,两种物质都能发生酯化反应和氧化反应
D.N分子中,可能在同一平面上的原子最多有14个
难度: 中等查看答案及解析
-
甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是

A.甲、乙的化学式均为C8H14
B.乙的二氯代物共有7种(不考虑立体异构)
C.丙的名称为乙苯,其分子中所有碳原子可能共平面
D.甲、乙、丙均能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
分子式为C6H10O3,能与NaHCO3反应产生无色气体,且与新制的Cu(OH)2悬浊液共热会出现砖红色沉淀的有机物有(不含立体异构)
A.8种 B.9种 C.12种 D.13种
难度: 中等查看答案及解析
-
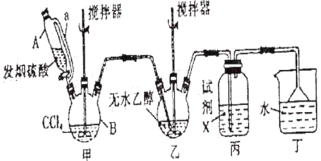
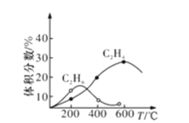
某研究小组探究石蜡油裂解产物,设计如图实验。下列说法正确的是

A.实验完毕后先熄灭酒精灯后拆导管
B.两支试管中发生的反应类型相同
C.可观察到B和C试管中液体褪色和分层
D.本实验能证明其产物含有碳碳不饱和键
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去
SO2具有还原性
B
向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色沉淀
Ksp(CuS)<Ksp(ZnS)
C
将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液,溶液变红
稀硫酸能氧化Fe2+
D
向AgNO3溶液中滴加过量氨水,得到澄清溶液
Ag+与NH3·H2O能大量共存
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法不正确的是
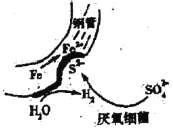
A.正极的电极反应式为:2H2O+2e-=H2+2OH-
B.SO42-与H2的反应可表示为:4H2+SO42-
S2-+4H2O
C.钢管腐蚀的直接产物中含有FeS、Fe(OH)3
D.在钢管表面镀锌可减缓钢管的腐蚀
难度: 中等查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数
Ka=1.75×10﹣5
Ka=2.98×10﹣8
Ka1=4.3×10﹣7
Ka2=5.61×10﹣11
Ka1=1.54×10﹣2
Ka2=1.02×10﹣7
下列离子方程式正确的是( )
A.少量的CO2通入NaClO溶液中:CO2+H2O+2ClO﹣═CO32﹣+2HClO
B.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32﹣═SO32﹣+2HCO3﹣
C.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO
D.相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3﹣═CO2↑+2H2O
难度: 中等查看答案及解析
-
常温下,用0.100mol·L-1NaOH溶液滴定10mL0.100mol·L-1H3PO4溶液,曲线如图所示。下列说法正确的是

A.滴定终点a可选择酚酞作指示剂
B.c点溶液中c(Na+)>3c(
)+2c(
)+c(
)
C.b点溶液中c(
)>c(
)>c(
)
D.a、b、c三点中水的电离程度最小的是c
难度: 中等查看答案及解析