-
下列物质制造或使用过程中没有发生化学变化的是( )
A
B
C
D




明矾做净水剂
丙烯制造聚丙烯熔喷布
氨气制造液氨冷却剂
含碳酸氢钠的抗酸药治疗胃酸过多
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
过氧乙酸是一种绿色生态杀菌剂,结构简式为
,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
A.过氧化氢的电子式
B.乙酸溶于水:CH3COOH=CH3COO-+H+
C.过氧乙酸中含有极性共价键和非极性共价键
D.制备过氧乙酸的化学反应方程式:CH3COOH+H2O2
CH3COOOH+H2O
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.纤维素属于天然有机高分子
B.油脂的皂化、淀粉制葡萄糖均属于水解反应
C.碳链中含碳碳双键的油脂,主要是低沸点的植物油
D.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
难度: 简单查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期主族元素。X与Z最外层电子数相同,X2-和Y+的电子层结构相同,Y的原子半径在短周期主族元素原子中最大。下列说法正确的是( )
A.原子半径:Z>W
B.还原性:X2->Z2-
C.最高价氧化物的水化物酸性:Z>W
D.X、Y、Z形成的化合物水溶液一定显中性
难度: 简单查看答案及解析
-
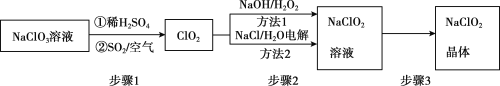
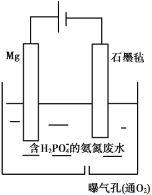
利用偏铝酸钠(NaA1O2)溶液电解法制备氢氧化铝的简易装置如图所示,其中两电极均为惰性电极。下列说法正确的是( )
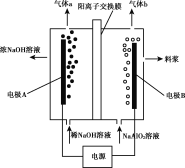
A.电极A为阳极
B.气体b为H2
C.所得料浆液的pH大于原料NaA1O2溶液的pH
D.该方法总反应方程式是:4NaA1O2+10H2O
4A1(OH)3+4NaOH+O2↑+2H2↑
难度: 中等查看答案及解析
-
向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
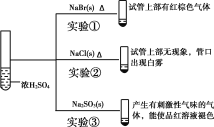
A.对比实验①和②可知还原性:Br->Cl-
B.对比实验①和③可知氧化性:Br2>SO2
C.对比实验②和③可知酸性:H2SO4>HCl>H2SO3
D.由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
难度: 中等查看答案及解析
-
某树脂的结构片断如图所示,下列关于该树脂的说法不正确的是( )(图中~~~表示链延长)
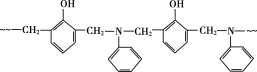
A.合成该树脂的反应为缩聚反应
B.理论上合成该树脂的原料比例相同
C.合成该树脂的单体之一甲醛可由甲醇氧化得到
D.该树脂难溶于水
难度: 困难查看答案及解析
-
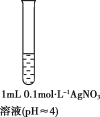
下列用于解释事实的离子方程式不正确的是
A.向
悬浊液中加入
溶液,有黑色难溶物生成:
B.向酸性
溶液中加入
固体,溶液紫色褪去:
C.向
溶液中加入过量澄清石灰水,有白色沉淀生成:
D.向稀硝酸中加入铜粉,溶液变蓝色:
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.23gNO2与足量水反应,转移的电子数约为6.02×1023
B.标准状况下,22.4L15NH3含有的质子数约为6.02×1024
C.常温下,1L0.1mo1•L-1NH4NO3溶液中含有的NH4+数约为6.02×1022
D.密闭容器中,1molNO与0.5molO2充分反应后,容器中分子数约为6.02×1023
难度: 简单查看答案及解析
-
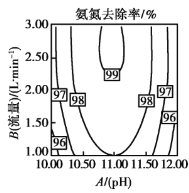
常温下,向
溶液中滴加少量
溶液,反应原理如图所示。关于该反应过程的说法正确的是
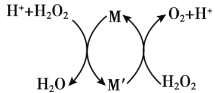
A.该反应过程中,
是
是
B.当有
生成时,转移
电子
C.在
分解过程中,溶液的
逐渐降低 D.
的氧化性比
强,还原性比
弱
难度: 中等查看答案及解析
-
氯化氢直接氧化法制氯气的反应是4HCl(g)+O2(g)
2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
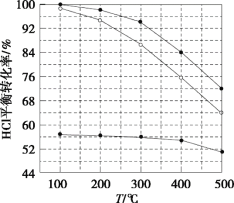
A.K(300℃)>K(400℃)
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当c(HCl):c(O2)进料比过低时,HCl的转化率较低,且不利于分离O2和Cl2
D.若HCl的初始浓度为c,进料比为1:1时,K(500℃)=
难度: 中等查看答案及解析
-
下列实验的现象与结论相对应的是( )
A
B
C
D
实验
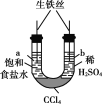
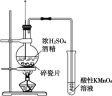
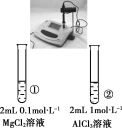
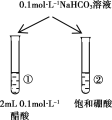
现象
一段时间后,a管液面高于b管液面
酸性KMnO4溶液褪色
pH计测得①中pH大于②中pH
试管①中有大量气泡,试管②中无现象
结论
a管发生吸氧腐蚀,b管发生析氢腐蚀
有乙烯生成可以使酸性KMnO4溶液褪色
金属性:Mg>Al
酸性:醋酸>碳酸>硼酸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
25℃下,水中碳酸化合物的三种微粒占总浓度的百分比随pH变化如图所示。25℃时,向10mL0.1mol・L-lNa2CO3溶液中逐滴加入0.1mol・L-1稀盐酸,下列说法正确的是( )
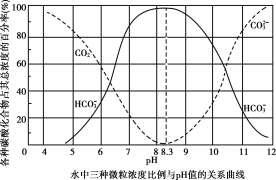
A.0.1mol・L-lNa2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.溶液pH=8.3时,c(Na+)=c(C1-)
C.溶液pH=7时,加入盐酸体枳大于10mL
D.溶液pH=6时的导电能力强于pH=11时的导电能力
难度: 中等查看答案及解析
-
碲(
)元素在元素周期表中位于第
族,其单质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是
、含
等杂质)中提取单质碲,步骤如下:
①将铜阳极泥在空气中焙烧使碲转化为
;
②用
溶液碱浸;
③以石墨为电极电解②所得溶液获得
。
已知:
微溶于水,易与较浓的强酸、强碱反应。
下列说法不正确的是
A.
中,
的化合价是-2
B.步骤②中,碱浸的离子方程式是
C.步骤③中,阴极上发生反应的电极方程式是:
D.在阳极区溶液中检验出有
存在,可能原因是阳极生成的氧气氧化
得到
难度: 简单查看答案及解析