-
下列说法正确的是
A. 18O2和16O2互为同位素
B. 正己烷和2,2−二甲基丙烷互为同系物
C. C60和C70是具有相同质子数的不同核素
D. H2NCH2COOCH3和CH3CH2NO2是同分异构体
难度: 中等查看答案及解析
-
下列制品采用的材料属于合金的是( )
A.大理石华表
B.青铜编钟
C.玻璃花瓶
D.翡翠如意




A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法不涉及氧化还原反应的是
A.雷雨肥庄稼——自然固氮
B.从沙滩到用户——由二氧化硅制晶体硅
C.干千年,湿万年,不干不湿就半年——青铜器、铁器的保存
D.灰肥相混损肥分——灰中含有碳酸钾,肥中含有铵盐
难度: 中等查看答案及解析
-
全氮类物质具有高密度、超高能量及爆炸产物无污染等优点,被称为没有核污染的“N2爆弹”。中国科学家胡炳成教授团队近日成功合成全氮阴离子N5-,N5-是制备全氮类物质N10(其中含有
和N5-两种离子)的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源 B.每个N5+中含有5个原子核
C.每N5-中含有36个质子 D.N10结构中含非极性共价键和离子键
难度: 中等查看答案及解析
-
下列有关铁及其化合物的说法中不正确的是
A.为了防止氯化亚铁溶液久置变质,常在其溶液中加入少许铁钉
B.将饱和FeCl3溶液滴入沸水中,能形成胶体
C.新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加铁粉,然后过滤
难度: 中等查看答案及解析
-
下列用于解释事实的离子方程式不正确的是
A.向
悬浊液中加入
溶液,有黑色难溶物生成:
B.向酸性
溶液中加入
固体,溶液紫色褪去:
C.向
溶液中加入过量澄清石灰水,有白色沉淀生成:
D.向稀硝酸中加入铜粉,溶液变蓝色:
难度: 简单查看答案及解析
-
芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是

A.汉黄芩素的分子式为 C16H12O5
B.该物质遇 FeCl3 溶液显色
C.1 mol 该物质与溴水反应,最多消耗 2mol Br2
D.与足量 H2 发生加成反应后,该分子中官能团的种类减少 3 种
难度: 中等查看答案及解析
-
研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是
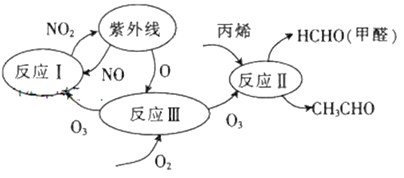
A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
难度: 简单查看答案及解析
-
X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是
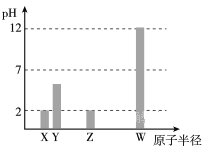
A.X是硫元素
B.Y的最高价氧化物的电子式为
C.W的最高价氧化物对应的水化物中仅含离子键
D.Z的最高价氧化物对应水化物的化学式为HClO4
难度: 中等查看答案及解析
-
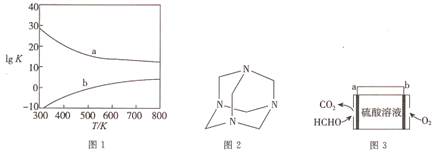
氯化氢直接氧化法制氯气的反应是4HCl(g)+O2(g)
2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
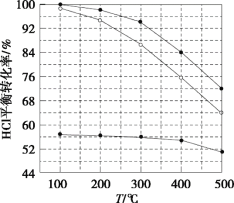
A.K(300℃)>K(400℃)
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当c(HCl):c(O2)进料比过低时,HCl的转化率较低,且不利于分离O2和Cl2
D.若HCl的初始浓度为c,进料比为1:1时,K(500℃)=
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
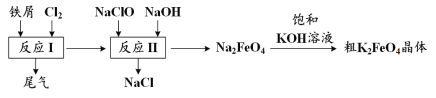
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
难度: 中等查看答案及解析
-
利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
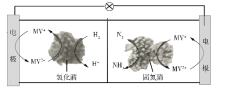
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+
2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
难度: 中等查看答案及解析
-
一定条件下,反应:6H2(g)+2CO2(g)
C2H5OH(g)+3H2O(g)的数据如图所示。
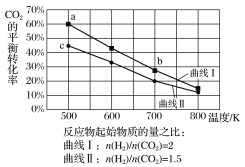
下列说法正确的是( )
A.该反应为吸热反应
B.达平衡时,v正(H2)=v逆(CO2)
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90%
难度: 中等查看答案及解析
-
25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L−1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
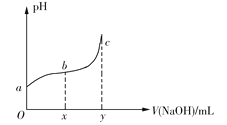
A.若a点pH=4,且c(Cl−)=mc(HClO),则HClO的电离平衡常数为
B.若x=100,b点对应溶液中,c(OH−)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH−)−c(H+)=2c(Cl−)+c(HClO)
D.b→c段,随NaOH溶液的滴入,
逐渐增大
难度: 困难查看答案及解析