-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数为内层电子数的3倍,X在短周期主族元素中金属性最强,W与Y属于同一主族。下列叙述正确的是( )
A. 原子半径:r(Z)>r(X)>r(W)
B. W的简单气态氢化物的热稳定性比Y的弱
C. 由W与X形成的一种化合物可作供氧剂
D. Y的最高价氧化物对应的水化物的酸性比Z的强
难度: 中等查看答案及解析
-
下列说法中,正确的是
A. 将2 g H2与足量的N2混合,充分反应后转移的电子数为2NA
B. 1molNa218O2与足量水反应,最终水溶液中18O原子为2NA个
C. 常温下,46gNO2和N2O4组成的混合气体中所含有的分子数为NA
D. 100mL 12mol/L的浓HNO3与过量Cu反应,转移的电子数大于0.6NA
难度: 困难查看答案及解析
-
2018年是“2025中国制造”启动年,而化学与生活、人类生产、社会可持续发展密切相关,下列有关化学知识的说法错误的是( )
A.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.用聚氯乙烯代替木材生产快餐盒,以减少木材的使用
C.碳纳米管表面积大,可用作新型储氢材料
D.铜导线和铝导线缠绕连接处暴露在雨水中比在干燥环境中更快断裂的主要原因是发生了电化学腐蚀
难度: 中等查看答案及解析
-
对甲基苯乙烯(
)是有机合成的重要原料。下列对其结构与性质的推断错误的是( )
A. 分子式为
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种
不考虑立体异构
D. 分子中所有原子可能处于同一平面
难度: 中等查看答案及解析
-
向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,下列关于实验现象的叙述不正确的是( )
A.先生成白色沉淀,沉淀消失
B.生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl-
C.生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl
D.若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后沉淀消失
难度: 中等查看答案及解析
-
为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
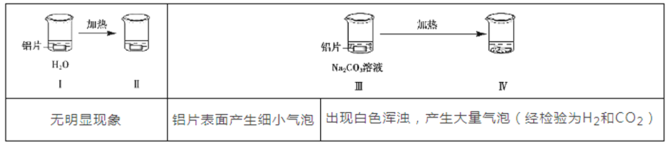
下列说法不正确的是
A.Na2CO3溶液中存在水解平衡:
+H2O⇌
+OH-
B.对比Ⅰ、Ⅲ,推测Na2CO3溶液能破坏铝表面的氧化膜
C.Ⅳ溶液中可能存在大量Al3+
D.推测出现白色浑浊的可能原因:
+
+H2O=Al(OH)3↓+
难度: 中等查看答案及解析
-
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是
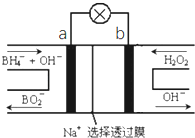
A.放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
B.电极a采用MnO2,MnO2既作电极材料又有催化作用
C.电池放电时Na+从b极区移向a极区
D.电池的负极反应为
+2H2O﹣8e-=
+8H+
难度: 中等查看答案及解析

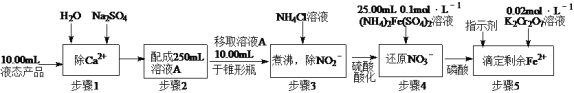
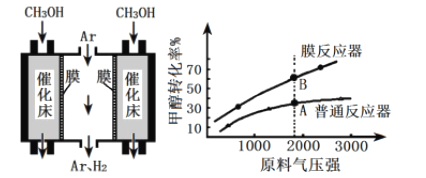

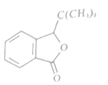
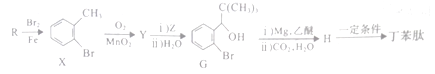
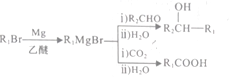
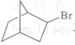 为原料合成
为原料合成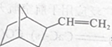 ,设计合成路线:________________。
,设计合成路线:________________。