-
下列物质与其用途不相符的是
A.乙二醇——抗冻剂 B.NaCl——制纯碱
C.Al2O3——焊接钢轨 D.甲苯——制炸药
难度: 中等查看答案及解析
-
现代社会的发展与进步离不开材料,下列有关材料的说法不正确的是( )
A.港珠澳大桥路面使用了沥青,沥青可以通过石油分馏得到
B.用于新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
C.被誉为“中国天眼”的射电望远镜,其“眼眶”的结构钢梁属于合金材料
D.新型聚氨酯迷彩伪装涂料可用于军车多环境下的隐身,聚氨酯属于无机非金属材料
难度: 中等查看答案及解析
-
某铁柱需长期浸入水下,为了减少腐蚀,下列措施中不能达到目的是
A.在铁柱上铆上一些锌片 B.将铁柱与直流电源的正极相连
C.在铁柱表面涂上一层较厚的沥青 D.在铁柱表面镀锡
难度: 中等查看答案及解析
-
下列有关说法不正确的是( )
A.天然油脂都是混合物,没有恒定的熔点和沸点
B.乙烯和甲烷可用溴的四氯化碳溶液鉴别
C.
的名称为2-乙基丙烷
D.有机物
分子中所有碳原子不可能在同一个平面上
难度: 简单查看答案及解析
-
下列各微粒的电子排布式或电子排布图不符合能量最低原理的是( )
A.
B.
C.F
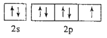 D.Na+
D.Na+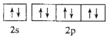
难度: 简单查看答案及解析
-
下列有关化合物X的叙述正确的是( )

A.X分子能发生氧化、取代、消去反应 B.X分子只存在2个手性碳原子
C.X分子中含有五种官能团 D.1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH
难度: 中等查看答案及解析
-
关于某无色溶液中所含离子的鉴别,下列判断正确的是( )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在
B.通入Cl2后,溶液变为深黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时,可确定有SO42-存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在
难度: 简单查看答案及解析
-
下列解释事实的化学用语不正确的是( )
A.[Ag(NH3)2]OH溶液呈碱性:[Ag(NH3)2]OH=[Ag(NH3)2]++OH-
B.向Cu(OH)2沉淀中加入氨水溶【解析】
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-C.电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e-=H2↑+ 2OH-
D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e-= Fe3+
难度: 中等查看答案及解析
-
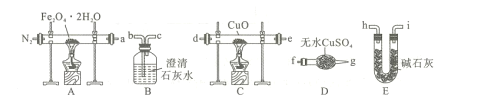
下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是( )
A
B
C
D
实验目的
制备氢氧化铁胶体
分离乙酸乙酯和饱和Na2CO3溶液
除去CO2中的少量HCl
收集NO2
实验装置




A.A B.B C.C D.D
难度: 简单查看答案及解析
-
利用固体表面催化工艺进行NO分解的过程如下图所示。下列说法不正确的是
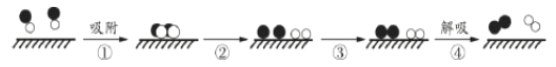
A.该分解过程是:2NO
N2+O2
B.实验室制取NO可以用铜与稀硝酸反应
C.过程②释放能量,过程③吸收能量
D.标准状况下,NO分解生成5.6 LN2转移电子数约为6.02×1023
难度: 中等查看答案及解析
-
下图是常温钠离子全固态浓差电池工作示意图。正极材料为层状含钠过渡金属氧化物,负极为钠锡合金(Na15Sn4)。下列说法合理的是( )。
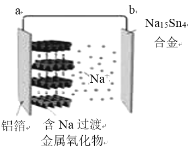
A.该电池工作时不发生氧化还原反应 B.放电时,负极的反应为:Na15Sn4-15e-=15Na++4Sn
C.充电时,Na+会被吸附进入过渡金属氧化层 D.充电时,a极接电源的负极,b极接电源的正极
难度: 中等查看答案及解析
-
T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是( )
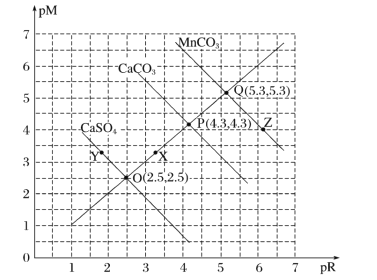
A.Y点:c(Ca2+)>c(SO42-),Z点:c(CO32-)>c(Mn2+)
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,CaSO4(s)+CO32-(aq)
CaCO3(s)+SO42-(aq)的平衡常数K的数量级为103
难度: 中等查看答案及解析
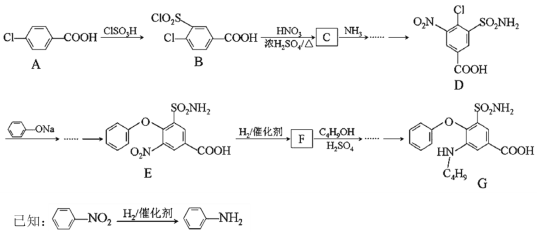
 的合成路线为_______。
的合成路线为_______。