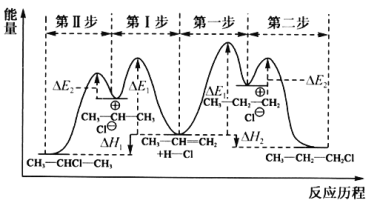
-
下列有关我国最新科技成果的说法中错误的是
A.北斗卫星的太阳能电池板可将太阳能转化为电能
B.国产飞机C919使用的航空煤油可从石油中分馏得到
C.石墨烯属于有机高分子材料
D.极地考查船“雪龙2号”船身上镀的锌层可减缓铁制船体遭受的腐蚀
难度: 简单查看答案及解析
-
柠檬烯
具有良好的镇咳、祛痰、抑菌作用。下列关于柠檬烯的说法正确的是( )
A.能使酸性高锰酸钾溶液褪色,其褪色原理与
相同
B.能发生氧化反应、加成反应、取代反应、缩聚反应
C.与乙烯互为同系物,其一氯代物有8种
D.分子中所有碳原子可能处于同一平面
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法正确的是
A.标准状况下,71gCl2溶于足量水,所得溶液中Cl2、HClO和ClO-三种微粒总数为NA
B.25℃时,pH=2的CH3COOH溶液中含有H+的数目为0.01NA
C.1molFeI2与足量氯气反应时转移的电子的数目为2NA
D.标准状况下,2.24LCH3Cl含有碳氯键的数目为0.1NA
难度: 中等查看答案及解析
-
下列实验操作对应的现象不符合事实的是
实验操作
现象
A
向盛有饱和硫代硫酸钠溶液的试管中滴加稀硫酸
有刺激性气味气体产生,溶液变浑浊
B
向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后滴加KSCN溶液
溶液黄色逐渐消失,滴加KSCN后溶液颜色不变
C
向盛有Br2的CCl4溶液的试管中通入少量乙炔,静置
溶液逐渐褪色,静置后观察到溶液有分层现象
D
将淀粉溶液和淀粉酶的混合物放入玻璃纸(半透膜)袋中,扎好袋口,浸入流动的温水中,经足够时间后,取少量袋内液体分别与碘水和新制Cu(OH)2悬浊液(加热)反应
两者均无明显变化
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
一种锂铜可充电电池,工作原理如图。在该电池中,非水系电解液和水系电解液被锂离子固体电解质陶瓷片(LISICON)隔开。下列说法不正确的是
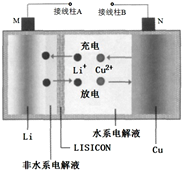
A.陶瓷片允许Li+ 通过,不允许水分子通过
B.放电时,N为电池的正极
C.充电时,阴极反应为:Li++e−=Li
D.充电时,接线柱A 应与外接电源的正极相连
难度: 中等查看答案及解析
-
常温下,HCOOH和CH3COOH的电离常数分别1.80×10−4和1.75×10−5。将pH=3,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg
的变化如图所示。下列叙述错误的是( )
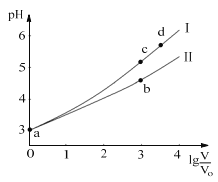
A.溶液中水的电离程度:b点<c点
B.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.从c点到d点,溶液中
不变(HA、A-分别代表相应的酸和酸根离子)
D.若两溶液无限稀释,则它们的c(H+)相等
难度: 中等查看答案及解析
-
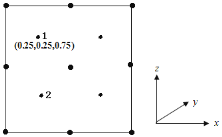
我国科学家意外发现一种罕见无机化合物YZX2W3(结构如图所示) ,其中W、X、Y为同一短周期元素, X、Z为短周期同一主族元素且Z的核电荷数是X的2倍,下列说法正确的是
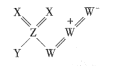
A.元素非金属性强弱顺序为X>Y> W
B.Z的氧化物的水化物是强酸
C.NaY的水溶液不能存放在玻璃试剂瓶中
D.X与Z具有相同的最高化合价
难度: 中等查看答案及解析