-
一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
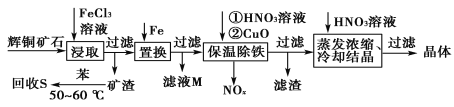
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
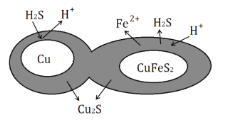
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。
-
一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
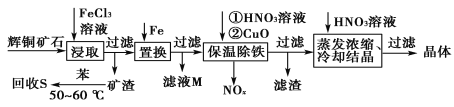
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___。
(4)向滤液M中加入(或通入)___(填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_。
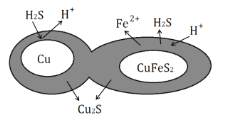
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___mol。
-
一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜晶体的工艺流程如图所示:
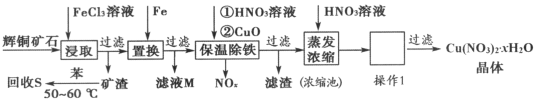
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S+2CuCl2=4CuCl+S;②__________。
(3)向滤液M中加入(或通入)_______________(填字母),所得物质可循环利用。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(4)“保温除铁”过程中,加入CuO的目的是______________;向浓缩池中加入适量HNO3的作用是_____________。操作1是_______________。
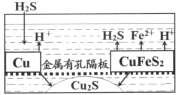
(5)某探究性小组的研究成果如图所示,可以用废铜屑和黄铜矿来富集Cu2S。通入的硫化氢的作用是_____________,当转移0.2mol电子时,生成Cu2S________mol。
-
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
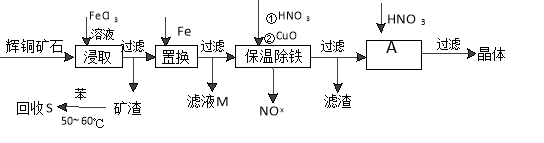
(1)写出浸取过程中Cu2S溶解的离子方程式 。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是 、 。
(3)保温除铁过程中加入CuO的目的是 。
(4)A步操作为 要用硝酸调节溶液的pH,其理由是 。
-
(12分)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
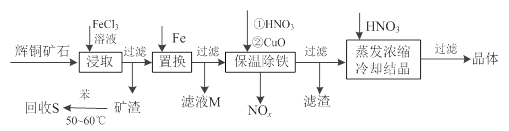
(1)写出浸取过程中Cu2S溶解的离子方程式________。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是________、 ________。
(3)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是________。
-
(12分)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
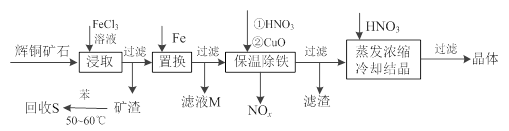
(1)写出浸取过程中Cu2S溶解的离子方程式________。
(2)回收S过程中温度控制在50℃~60℃之间,不宜过高或过低的原因是________、 ________。
(3)气体NOx 与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________;向滤液M中加入(或通入)下列________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中加入CuO的目的是________;蒸发浓缩时,要用硝酸调节溶液的pH,其理由是________。
-
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸銅的工艺流程如下所示:
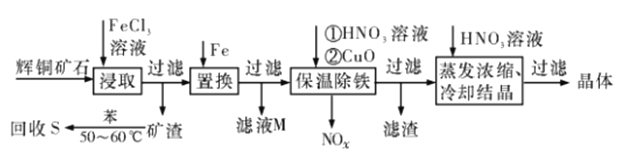
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_________。
(2)“矿渣”中除了S以外,还有_______(填化学式);“回收S”"过程中温度控制在50~60℃之间,不宜过高或过低的原因是_________ 。
(3)“保温除铁”过程中,加入CuO的目的是_________;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由是_________ 。
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________;向“滤液M”"中加入(或通入) ________ (填字母代号),可得到另一种流程中可循坏利用的物质。
A.铁 B.氯气 C.高锰酸钾
-
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
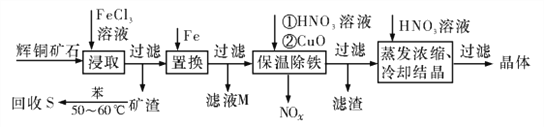
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________________________
(2)“矿渣”中除了S以外,还有____________(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是____________________________________
(3)“保温除铁”过程中,加入CuO的目的是____________________________________;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是____________
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________;向“滤液M”中加入(或通入) ____________(填母代号),可得到另一种流程中可循坏利用的物质。
a.铁 b.氯气 c.高锰酸钾
-
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
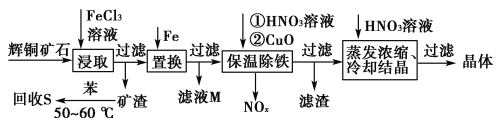
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:______________________________________________________________。
(2)“回收S”过程中温度控制在50~60 ℃之间,不宜过高或过低的原因是______________________________________________________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为_________________________________________________;
向滤液M中加入(或通入)________(填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“保温除铁”过程中,加入CuO的目的是__________;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由____________________。
-
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
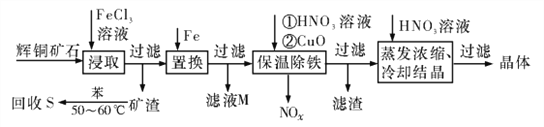
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:________________________
(2)“矿渣”中除了S以外,还有____________(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是____________________________________
(3)“保温除铁”过程中,加入CuO的目的是____________________________________;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是____________
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________;向“滤液M”中加入(或通入) ____________(填母代号),可得到另一种流程中可循坏利用的物质。
a.铁 b.氯气 c.高锰酸钾












