-
已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2=HCN+NaNO2,NaCN+HF=HCN+NaF,NaNO2+HF==HNO2+NaF,由此可判断下列叙述中正确的是( )
A.HF的电离常数是① B.HNO2的电离常数是①
C.HCN的电离常数是② D.HNO2的电离常数是③
难度: 中等查看答案及解析
-
一定温度下,反应N2(g)+O2(g)⇌2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
A.缩小体积使压强增大 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
难度: 简单查看答案及解析
-
已知反应:①
,②
。下列结论正确的是
A.碳的燃烧热大于110.5 kJ·mol−1
B.①的反应热为221 kJ·mol−1
C.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
难度: 简单查看答案及解析
-
已知:
。下列说法正确的( )
A.在相同条件下,1mol
与1mol
的能量总和大于2mol
的能量
B.1mol
与1mol
反应生成2 mol液态HF放出的热量小于270kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用下图来表示
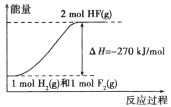
难度: 简单查看答案及解析
-
下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g)△H=-38.6kJ·mol-1
C.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
难度: 中等查看答案及解析
-
已知氟化氢气体中有平衡关系:
①2H3F3(g)
3H2F2(g) ΔH1=+a kJ·mol-1
②H2F2(g)
2HF(g) ΔH2=+b kJ·mol-1
已知a、b均大于0,则可推测反应H3F3(g)===3HF(g)的ΔH为( )
A.+(a+b) kJ·mol-1
B.+(a-b) kJ·mol-1
C.+(a+3b) kJ·mol-1
D.+(0.5a+1.5b) kJ·mol-1
难度: 简单查看答案及解析
-
下列有关化学平衡常数的描述中正确的是( )
A. 化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
B. 相同温度下,反应A+B⇌C与反应C⇌A+B的化学平衡常数相同
C. 反应2SO2(g)+O2(g)⇌2SO3(g) ΔH<0的化学平衡常数随温度升高而增大
D. 反应A(g)+B(g)⇌2C(g)的平衡常数表达式为K=
难度: 中等查看答案及解析
-
在一定体积的密闭容器中进行反应:N2(g)+3H2(g)
2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是
A.N2为0.2 mol/L,H2为0.6 mol/L
B.N2为0.15 mol/L
C.N2、H2均为0.18 mol/L
D.NH3为0.4 mol/L
难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g) ⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) ⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定移动
④有气体参加的反应平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A. ①④ B. ①②③
C. ②③④ D. ①②③④
难度: 中等查看答案及解析
-
在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
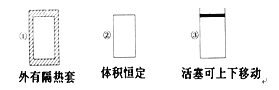
A. ③②① B. ③①② C. ①②③ D. ②①③
难度: 困难查看答案及解析
-
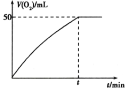
一定温度下,在一容积不变的密闭容器中,充入一定量HI气体,发生如下可逆反应:
2HI(g)⇌H2(g)+I2(g)ΔH>0。下列说法正确的是( )
A.若每消耗2n mol HI的同时生成n mol H2,表明该反应已达平衡
B.容器内的压强不发生变化,表明该反应已达平衡
C.平衡时,若其他条件不变,再充入一定量HI,重新达平衡后,I2的百分含量增大
D.平衡时,若其他条件不变,升高温度,混合气体的颜色加深
难度: 中等查看答案及解析
-
水是一种重要的资源,关于水的下列说法错误的是
A.水是一种极弱的电解质
B.水的离子积可表示为
C.常温下水呈中性,即
D.升高温度,
增大,显弱酸性
难度: 简单查看答案及解析
-
下列各项中的两个量,其比值一定为
的是
A.液面在“0”刻度时,
碱式滴定管和
碱式滴定管所盛液体的体积
B.相同温度下,
醋酸溶液和
醋酸溶液中的
C.在
溶液中,
与
D.相同温度下,等浓度的
和NaOH溶液,前者与后者的
难度: 简单查看答案及解析
-
关于pH的测定下列说法正确的是
A.pH试纸在使用之前应用蒸馏水润湿
B.用广泛pH试纸测得某盐酸的pH=2.3
C.利用酸碱指示剂可以测溶液的pH
D.pH计是精确测定溶液pH的仪器
难度: 简单查看答案及解析
-
下列各离子①H+ ②Cl- ③Al3+ ④K+ ⑤S2- ⑥OH- ⑦NO3- ⑧NH4+中,不影响水的电离平衡的是( )
A.①③⑤⑦⑧ B.②④⑦ C.①⑥ D.②④⑥⑧
难度: 中等查看答案及解析
-
常温下,下列叙述正确的是
A.稀释pH=3的醋酸溶液,溶液中所有离子的浓度均降低
B.一定浓度的CH3COOH和NaOH溶液混合,溶液呈中性,则混合液中
C.pH均为11的NaOH和Na2CO3溶液中,水的电离程度相同
D.分别中和pH与体积相同的硫酸和醋酸溶液,硫酸消耗氢氧化钠的物质的量多
难度: 中等查看答案及解析
-
设有物质的量浓度为0.1mol/L和体积均相等的下列溶液:①H2CO3溶液 ②Na2CO3溶液 ③NaHCO3溶液 ④NH4HCO3溶液 ⑤(NH4)2CO3溶液。上列有关说法不正确的是
A.
最大的是②
B.
最大的是③
C.将溶液蒸干灼烧后只有①得不到对应的溶质
D.③④⑤既能与HCl反应,又能与NaOH反应
难度: 简单查看答案及解析
-
相同温度、相同浓度的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别是
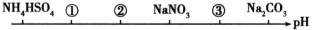
A.NH4Cl (NH4)2SO4 CH3COONa
B.(NH4)2SO4 NH4Cl CH3COONa
C.(NH4)2SO4 NH4Cl NaOH
D.CH3COOH NH4Cl (NH4)2SO4
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.
的溶液中:
、
、
、
B.由水电离的
的溶液中:
、
、
、
C.
的溶液中:
、
、
、
D.
的溶液中:
、
、
、
难度: 中等查看答案及解析
-
下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是
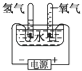
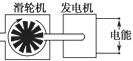

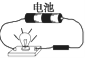
A.电解水 B.水力发电 C.太阳能热水器 D.干电池
难度: 简单查看答案及解析
-
下列有关电池的叙述正确的是
A.锌锰干电池中,锌电极是负极
B.手机用的锂离子电池属于一次电池
C.氢氧燃料电池工作时氢气在负极被还原
D.太阳能电池的主要材料为二氧化硅
难度: 简单查看答案及解析
-
电化学装置工作时,下列电极上发生的反应一定是氧化反应的是
A.负极 B.阴极 C.铜电极 D.石墨电极
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-
D.工业上电解饱和和食盐水的阳极反应: 2Cl--2e-=Cl2↑
难度: 中等查看答案及解析
-
原电池电极的“正”与“负”不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
A.由
和
溶液组成的原电池中,负极反应式为:
B.由
和稀硫酸组成的原电池中,负极反应式为
C.由
和
溶液组成的原电池中,负极反应式为:
=
D.由
和浓
组成的原电池中,负极反应式为:
难度: 中等查看答案及解析
-
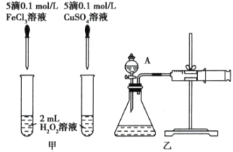
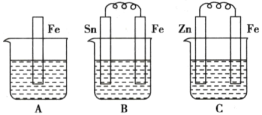
下列装置中,Fe腐蚀由快到慢的顺序为 ( )
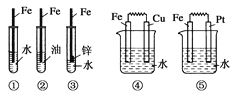
A.⑤④③②① B.⑤④①②③ C.⑤③④①② D.①②④③⑤
难度: 中等查看答案及解析