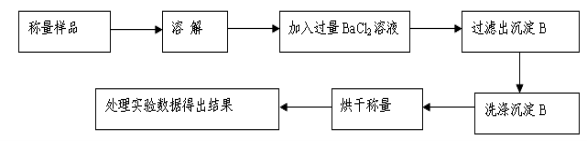
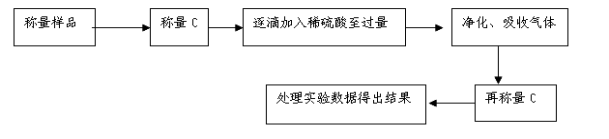
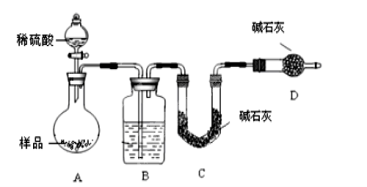
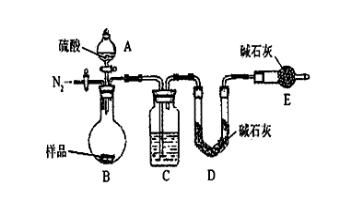
-
下列有关叙述中正确的是:( )
A.难溶于水的电解质一定是弱电解质
B.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C.易溶于水的电解质一定是强电解质
D.强电解质在水溶液中的电离过程是不可逆的
难度: 中等查看答案及解析
-
在平衡体系中:H2S
H++HS-,HS-
H++S2-,增大溶液的pH值时,则c(S2-)变化正确的是( )
A.增大 B.可能增大也可能减小 C.减小 D.不变
难度: 中等查看答案及解析
-
下列事实能说明醋酸是弱酸的是
① 醋酸钠溶液中CH3COO-与CH3COOH共存
② 0.1 mol/L的醋酸钠溶液的pH值约为9
③ 等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④ 0.1mol/L的醋酸的pH值约为4.8
⑤ pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多
A.①②④⑤ B.②④ C.②③④ D.②③
难度: 中等查看答案及解析
-
常温下,等体积的下列各组酸和碱的溶液混和后,溶液pH<7的是
①pH之和为14的硝酸和氢氧化钾溶液; ②pH之和为15的盐酸和氨水溶液;
③pH之和为14的醋酸和苛性钠溶液; ④pH之和为13的硫酸和氢氧化钡溶液。
A.② B.①② C.②③ D.③④
难度: 中等查看答案及解析
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
难度: 中等查看答案及解析
-
室温下,某无色透明溶液中由水电离出来的H+和OH—浓度的乘积为1×10—24,则此溶液中可能大量共存的离子组为( )
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
难度: 中等查看答案及解析
-
下列方程式书写正确的是
A.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO4-
B.H2SO3的电离方程式H2SO3
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3=Ca2++CO32-
难度: 中等查看答案及解析
-
25℃时,pH值都等于10的KOH溶液与CH3COOK溶液中水的电离程度比较( )
A.相等 B.前者比后者大
C.后者比前者大 D.两者都比纯水电离程度小
难度: 中等查看答案及解析
-
在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A.H+的物质的量 B.醋酸的电离常数
C.中和时所需NaOH的量 D.CH3COOH的物质的量
难度: 中等查看答案及解析
-
25℃时的下列溶液中,碱性最强的是( )
A.pH=11的溶液 B.c(OH-)=0.12 mol/L的溶液
C.1 L含有4 g NaOH的溶液 D.c(H+)=1×10-10 mol/L的溶液
难度: 中等查看答案及解析
-
下列操作中,能使电离平衡H2O
H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3固体
C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6
难度: 中等查看答案及解析
-
要求设计实验证明某种盐的水解是吸热的,下列回答正确的是( )
A.将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的
C.在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D.在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
难度: 中等查看答案及解析
-
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
难度: 中等查看答案及解析
-
在体积都为1L、pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下列各图所示内容比较符合客观事实的是

难度: 中等查看答案及解析
-
pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4:1的体积比混合,则溶液中c(H+)为(mol/L):
A.(4×10-9 + 1×10-12) 1/5 B. (8×10-9 + 1×10-12) 1/5
C.5×10-10 D.5×10-12
难度: 中等查看答案及解析