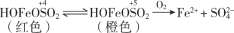-
垃圾分类有利于资源回收利用。下列垃圾的归类不合理的是
A
B
C
D
垃圾


归类




A.A B.B C.C D.D
难度: 简单查看答案及解析
-
据报道,我国科学家研制出以石墨烯为载体的催化剂,在 25℃下用 H2O2 直接将 CH4转化为含氧有机物,其主要原理如下图所示:
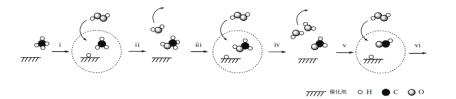
下列说法不正确的是
A.上图中
代表 H2O2
B.由上图可知,步骤 iv 生成的 H2O,其中的 H 原子全部来自 H2O2
C.步骤 i、ii 的总反应方程式是CH4+H2O2
CH3OH+H2O
D.根据以上原理,推测步骤 vi 生成 HCOOH 和 H2O
难度: 中等查看答案及解析
-
通过以下反应均可获取H2。
①C(s) + H2O (g) = CO(g)+H2(g) ΔH1=+ 131.3kJ·mol-1
②CH4(g) + H2O (g) = CO(g)+3H2(g) ΔH2=+ 206.1kJ·mol-1
③CO (g) + H2O (g) = CO2(g)+H2(g) ΔH3
下列说法正确的是
A.①中反应物的总能量大于生成物的总能量
B.②中使用适当催化剂,降低了活化能,同时可以使ΔH2 减小
C.若知反应C (s) + CO2(g) =2CO(g)的ΔH,结合ΔH1 可计算出ΔH3
D.由①、②计算反应CH4 (g) = C(s)+2H2(g)的ΔH = -74.8kJ·mol-1
难度: 中等查看答案及解析
-
用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) ΔH=-115.6kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是( )
A.气体的质量不再改变
B.氯化氢的转化率不再改变
C.断开4molH—Cl键的同时生成4molH—O键
D.n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
难度: 中等查看答案及解析
-
在一定条件下,利用 CO2 合成 CH3OH 的反应如下:CO2(g) + 3H2(g)
CH3OH(g) + H2O(g)△H1,研究发现,反应过程中会有副反应:CO2(g) + H2(g)
CO(g) + H2O(g) △H2。温度对 CH3OH、CO 的产率影响如图所示。下列说法中,不正确的是
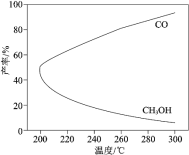
A.△H1 < 0,△H2 > 0
B.增大压强可以缩短合成反应达到平衡所需的时间
C.生产过程中,温度越高越有利于提高 CH3OH 的产率
D.合成 CH3OH 反应的平衡常数表达式是K=
难度: 中等查看答案及解析
-
下列化合物中,属于弱电解质的是
A.NaOH B.CH3COOH C.NH4Cl D.H2SO4
难度: 简单查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾溶液加热 B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体 D.小苏打溶液中加入少量NaCl固体
难度: 中等查看答案及解析
-
下列叙述正确的是
A.Na2CO3 溶液加水稀释后,恢复至原温度,pH 和 Kw 均减小
B.0.1mol/L CH3COONa 溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.在 KI 溶液中加入 AgCl 固体,溶液中 c(I-)减小
D.室温下,pH=5 的 CH3COOH 溶液和 pH=5 的 NH4Cl 溶液中,溶液中 c(H+)不相等
难度: 中等查看答案及解析
-
下列图示内容的对应说明正确的是
编号
A
B
C
D
图示
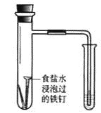
食盐水
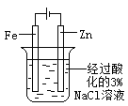
片刻后在Fe 电极附近滴入K3[Fe(CN)6]溶液


说明
验证铁钉发生
吸氧腐蚀
验证 Fe 电极被保护
该装置是牺牲阳极的阴极保护法
该化学反应为放热反应
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
下列用于解释事实的方程式书写不正确的是
A.0.1mol/L氨水的pH约为11.1:NH3·H2O
NH4++OH-
B.用明矾 [KAl(SO4)2·12H2O]作净水剂:Al3++3H2O
Al(OH)3(胶体)+3H+
C.用饱和Na2CO3溶液处理水垢中的CaSO4(微溶):Ca2++CO32-=CaCO3↓
D.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深:
(橙色)+H2O
2CrO42-(黄色)+2H+
难度: 中等查看答案及解析
-
汽车发动机中生成 NO 的反应为:N2(g) + O2(g)
2NO(g),t℃时,K= 0.09。在 t℃下甲、乙、丙三个恒容密闭容器中,投入 N2(g)和 O2(g)模拟反应,起始浓度如下表所示。
起始浓度
甲
乙
丙
c(N2)/mol·L-1
0.46
0.46
0.92
c(O2)/mol·L-1
0.46
0.23
0.92
下列判断不正确的是
A.起始时,反应速率:丙>甲>乙 B.平衡时,N2 的转化率:甲>乙
C.平衡时,c(NO):甲=丙>乙 D.平衡时,甲中 c(N2)= 0.4mol·L-1
难度: 中等查看答案及解析
-
在 100℃时,将 0.40 mol NO2 气体充入 2 L 的密闭容器中,发生如下反应:2NO2(g)
N2O4(g) ∆H < 0。监测反应获得如下数据:
时间/s
0
20
40
60
80
n(NO2)/mol
0.40
n1
0.26
n3
n4
n(N2O4)/mol
0.00
0.05
n2
0.08
0.08
下列说法正确的是
A.0~20 s 内,v(NO2) = 0.005 mol·L-1.s-1
B.若上述反应在 120℃时进行,则反应至 80 s 时,n(N2O4) < 0.08 mol
C.若仅将起始时充入 NO2 的量增至 0.80 mol,达平衡时 NO2 转化率将减少
D.59 s 时,c(NO2)一定大于 0.12 mol·L-1
难度: 困难查看答案及解析
-
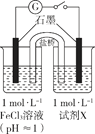
对FeCl3溶液与KI溶液的反应进行探究。关于实验的分析和结论不正确的是
实验操作
实验现象
1
取 2mL0.1mol/L KI 溶液于试管中,滴加0.1mol/L FeCl3溶液 3 滴,振荡,充分反应
溶液呈深棕黄色
2
将溶液均分后置于试管 1 和试管 2 中
向试管 1 中滴加 2 滴 0.1mol/L KSCN 溶液
溶液显红色
向试管 2 中加入1mL CCl4,充分振荡、静置
溶液分层,上层为浅棕黄色,下层为紫色
③
取试管 2 的上层液体置于试管 3 中,滴加 2滴 0.1mol/L KSCN 溶液
溶液微弱变红
A.FeCl3 与 KI 发生了氧化还原反应,有I2生成
B.试管 1 中溶液显红色证明FeCl3与 KI 的反应具有可逆性
C.试管 2 中上层溶液变为浅棕黄色是平衡移动的结果
D.试管 3 中红色比试管 1 中浅是平衡移动的结果
难度: 中等查看答案及解析
-
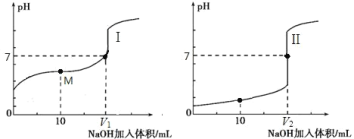
25℃时,浓度均为 0.1 mol/L 的溶液,其 pH 如下表所示。有关说法正确的是
序号
①
②
③
④
溶液
NaCl
CH3COONH4
NaF
NaHCO3
pH
7.0
7.0
8.1
8.4
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.①和③中阴离子的总浓度:c(Cl-) + c(OH-)>c(F-) + c(OH-)
D.④中:c(
) + 2c(
) + c(H2CO3) 0.1 mol/L
难度: 中等查看答案及解析
-
根据下列图示所得推论正确的是
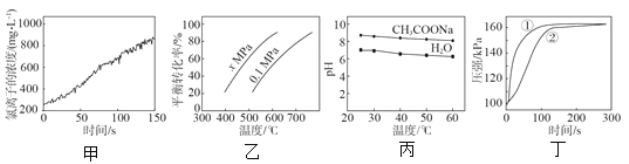
A.甲是新制氯水光照过程中氯离子浓度的变化曲线,推断次氯酸分解生成了 HCl 和 O2
B.乙是 C4H10(g)
C4H8(g) + H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的∆H>0、x>0.1
C.丁是 0.03g 镁条分别与 2 mL 2 mol/L 盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断①代表盐酸与镁条的反应
D.丙是 0.5 mol/L CH3COONa 溶液及水的 pH 随温度的变化曲线,说明随温度升高,CH3COONa 溶液中 c(OH-)减小
难度: 中等查看答案及解析
-
向10.00 mL 0.50 mol/L NaHCO3溶液中滴加不同浓度的CaCl2溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
实验
序号
c(CaCl2)(mol·L-1)
滴加CaCl2溶液时的
实验现象
加热浑浊液时的
实验现象
①
0.05
至1.32 mL时产生明显浑浊,但无气泡产生
有较多气泡生成
②
0.005
至15.60 mL时产生明显浑浊,但无气泡产生
有少量气泡生成
③
0.0005
至20 mL未见浑浊
A.①中产生浑浊的原因是c(Ca2+)·c(CO32−)>Ksp(CaCO3)
B.未加热前①和②中发生了反应:2HCO3-+Ca2+=CaCO3↓+H2CO3
C.加热浊液产生气泡主要是因为CaCO3受热分解产生了更多的CO2
D.向上述NaHCO3溶液中加入足量0.5 mol/LCaCl2溶液,可能同时产生浑浊和气泡
难度: 中等查看答案及解析
-
下述根据下列操作和现象,所得结论正确的是
实验操作及现象
实验结论
A
用石墨作电极电解CuSO4溶液,某电极附近有蓝色沉淀生成
该电极为阳极
B
向2 mL 0.1 mol·L-1 NaOH溶液中滴加3滴0.1 mol·L-1MgCl2溶液,出现白色沉淀后,再滴加3滴 0.1 mol·L-1FeCl3溶液,出现红褐色沉淀
溶解度:Mg(OH)2>Fe(OH)3
C
分别向2 mL 0.1 mol·L-1 CH3COOH溶液和2 mL 0.1 mol·L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液, 前者有气泡产生,后者无明显现象
酸性:CH3COOH>H2CO3>H3BO3
D
向2 mL 5%的双氧水中分别滴加2滴0.1 mol/L Fe2(SO4)3和0.1 mol/L CuSO4溶液,前者产生气泡较快
对双氧水分解催化效果:Fe3+>Cu2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
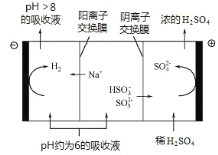
以氮气和水蒸气为原料,电化学合成氨装置(电极不参与反应)示意图如下。下列说法不正确的是
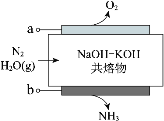
A.电极 a 连接电源的正极
B.OH−向电极 a 迁移
C.总反应:2N2+6H2O(g)
4NH3+3O2
D.电极 b 的电极反应:N2+6e−+6H+==2NH3
难度: 中等查看答案及解析
-
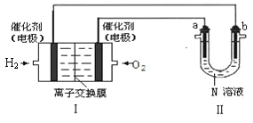
下列有关 2 个电化学装置的叙述不正确的是
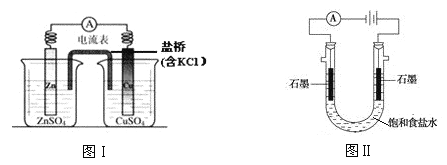
A.图Ⅰ,在不改变总反应的前提下,可用 Na2SO4 替换 ZnSO4,用石墨替换 Cu 棒
B.图Ⅰ,电流形成的完整过程是:负极 Zn-2e-=Zn2+,电子经导线流向正极,正极 Cu2++2e-=Cu
C.图Ⅱ,通电后向两极滴加酚酞,左侧变红
D.图Ⅰ,盐桥中 Cl-向左侧移动,图Ⅱ,溶液中 Cl-向右侧移动
难度: 简单查看答案及解析
-
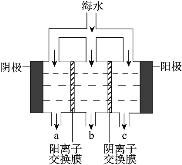
下图为氯碱工业的简易装置示意图,其中两电极均为惰性电极,下列说法正确的是
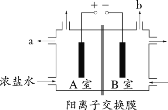
A.粗盐水中含有的少量 Ca2+和 Mg2+均可用 NaOH 除去
B.若电路中通过 0.2 mol 电子,理论上可在 b 处得到标准状况下 1.12 L 气体
C.a 处得到的是浓 NaOH 溶液
D.适当降低阳极电解液的 pH 有利于 Cl2 逸出
难度: 中等查看答案及解析
-
将镁条置于 pH=8.4 的饱和 NaHCO3 溶液中,镁条表面产生气体 a,一段时间后产生白色沉淀b。继续进行如下实验:
Ⅰ.将 a 通过澄清石灰水,变浑浊,继而通过足量 NaOH 溶液,再通入肥皂液,出现气泡,点燃气泡听到爆鸣声;
Ⅱ.向沉淀 b 中加入足量的稀盐酸,沉淀完全溶解,且产生无色气泡。下列说法不正确的是
A.饱和 NaHCO3 溶液中,c(
)< c(H2CO3)
B.沉淀 b 是 MgCO3
C.气体 a 中含有 CO2 和 H2
D.CO2 可能是
水解被促进产生的
难度: 困难查看答案及解析