-
下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质的是
A.FeSO4 B.MgSO4 C.AlCl3 D.NH4Cl
难度: 简单查看答案及解析
-
下列过程能实现化学能转化为电能的是( )



A. 蜡烛燃烧
B. 光合作用
C. 手机电池工作
D. 天然气加热水
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列物质属于弱电解质的是
A.NaCl B.NaOH C.CH3COOH D.CO2
难度: 简单查看答案及解析
-
下列反应中,属于吸热反应的是
A.Al与盐酸反应 B.盐酸和NaOH溶液反应
C.乙醇燃烧反应 D.Ba(OH)2·8H2O晶体与NH4Cl固体反应
难度: 简单查看答案及解析
-
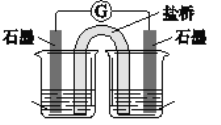
某锌铜原电池装置如图所示,下列说法不正确的是( )
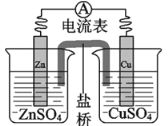
A.锌片作负极
B.该装置实现了氧化反应和还原反应分开进行
C.盐桥的作用是传导离子
D.电子从铜片流向锌片
难度: 简单查看答案及解析
-
下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )
A. 地下钢管连接镁块 B. 金属护栏表面涂漆
C. 汽车底盘喷涂高分子膜 D. 水中的钢闸门连接电源的负极
难度: 简单查看答案及解析
-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
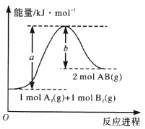
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ • mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
难度: 简单查看答案及解析
-
200℃、101kPa时,在密闭容器中充入1molH2和1molI2,发生反应I2(g)+H2(g)
2HI(g) ΔH=-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是
A.放出的热量小于14.9 kJ
B.反应容器内压强不再变化
C.HI生成的速率与HI分解的速率相等
D.单位时间内消耗a mol H2,同时生成2a mol HI
难度: 简单查看答案及解析
-
把0.02mol/LCH3COOH溶液和 0.01mol/LNaOH 溶液以等体积混和,溶液显酸性,则混合液中微粒浓度关系正确的为( )
A.c(CH3COO-)>c (Na+) B.c(OH-)>c(H+)
C.c(CH3COOH)>c(CH3COO-) D.c(CH3COOH)+c(CH3COO-)=0.02mol/L
难度: 简单查看答案及解析
-
对可逆反应
,下列图象正确的是( )
A.
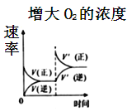 B.
B. 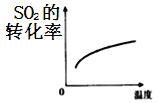
C.
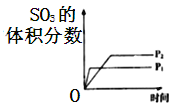 D.
D. 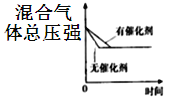
难度: 中等查看答案及解析