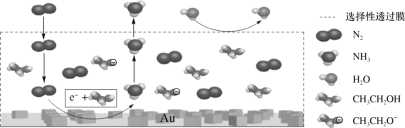
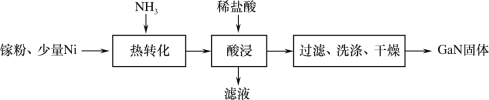
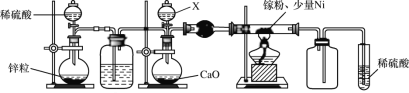
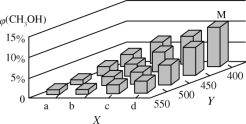
-
无纺布制成的医用口罩在抗击新型冠状病毒过程中发挥了重要作用,无纺布的主要原料是聚丙烯树脂。下列说法不正确的是( )
A.无纺布制成的医用口罩能有效预防病毒传染
B.聚丙烯树脂属于合成有机高分子材料
C.合成聚丙烯树脂的单体是丙烯
D.丙烯和聚丙烯树脂均属于纯净物
难度: 简单查看答案及解析
-
设阿伏加德罗常数为NA,下列说法正确的是( )
A.1molCl2与足量Fe反应,转移的电子数为3NA
B.22.4L(标准状况)15NH3含有的质子数为11NA
C.常温下,1L0.1mol/LMgCl2溶液中,含有Mg2+数为0.1NA
D.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
难度: 简单查看答案及解析
-
下列物质的用途不正确的是
A. 生石灰
B. 小苏打
C.阿司匹林
D.苯甲酸钠
物质


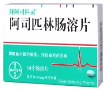

用途
抗氧化剂
糕点发酵粉
解热镇痛药
食品防腐剂
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列化学用语表示不正确的是( )
A.H2O分子的比例模型:

B.NaClO的电子式:
C.CO2的结构式:O=C=O
D.丙烷分子的球棍模型:
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明的溶液中:Fe3+、
、I-、
B.0.1 mol•L-1 KNO3 溶液中:Na+、Fe2+、Cl-、
C.使酚酞变红的溶液中:Na+、Mg2+、
、
D.
=1×10-12 的溶液:K+、Na+、
、
难度: 简单查看答案及解析
-
将NaCl溶于水配成1mol/L的溶液,溶解过程如图所示。下列说法正确的是( )
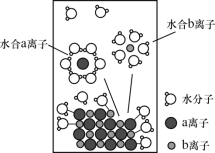
A.a离子为Cl-,b离子为Na+
B.溶液中含有NA个水合Na+
C.溶液中存在NaCl
Na++Cl-
D.NaCl溶解过程需要在容量瓶中进行
难度: 简单查看答案及解析
-
下列解释事实的离子方程式正确的是( )
A.Na2O2溶于水:Na2O2+2H2O=2Na++2OH﹣+O2↑
B.用石墨电极电解饱和食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑
C.用Na2CO3溶液处理锅炉水垢中的CaSO4:CaSO4+CO32-=CaCO3+SO42-
D.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+恰好沉淀完全:Ba2++SO42-=BaSO4↓
难度: 中等查看答案及解析
-
下列实验中,能达到相应实验目的的是( )
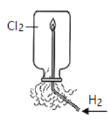

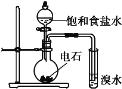

A.H2在Cl2中燃烧
B.证明氯化银溶
解度大于硫化银
C.证明乙炔可使溴水褪色
D.验证温度对平衡移动的影响
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是( )
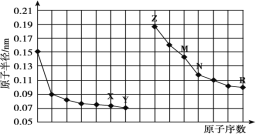
A.最高价氧化物对应水化物的碱性:Z<M
B.Y、R两种元素气态氢化物的稳定性:Y>R
C.X、N两种元素形成的化合物属于离子化合物
D.简单离子的半径:Z>M>X
难度: 简单查看答案及解析
-
甲烷燃烧时的能量变化如图,有关说法正确的是( )
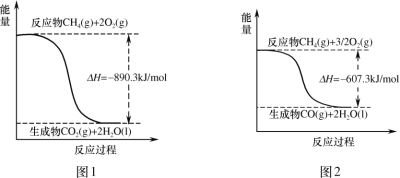
A.图1中反应为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=+890.3kJ/mol
B.图2中反应为:CH4(g)+
O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
C.由图可以推得:CO(g)+
O2(g)=CO2(g) H=﹣283kJ/mol
D.由图可以推知:等物质的量的CO2和CO,CO2具有的能量高
难度: 简单查看答案及解析
-
2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的反应式为LixC6+Li1﹣xCoO2
6C+LiCoO2(x<1)其工作原理如图所示。下列说法不正确的是( )
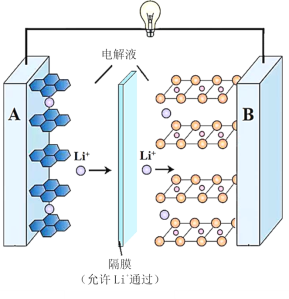
A.放电时A极电极式为:LixC6–xe-=6C+xLi+
B.放电时,若转移0.3mol电子,石墨电极将减重2.1g
C.充电时,A极接外电源的正极
D.该废旧电池进行“放电处理”有利于锂在B极回收
难度: 简单查看答案及解析
-
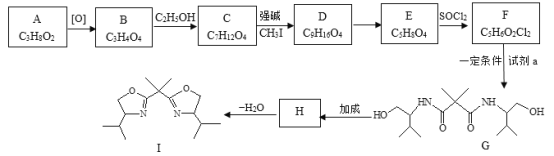
利用有机物X、Y合成广谱抗菌药物M的反应表示如图。下列说法不正确的是( )
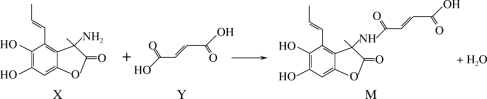
A.X分子与强酸、强碱均能发生反应
B.Y分子与丙烯酸分子互为同系物
C.X和Y均能使酸性高锰酸钾溶液褪色
D.X、Y合成M的反应类型为取代反应
难度: 简单查看答案及解析
-
用0.1000mol·L-1NaOH溶液分别滴定20.00ml0.1000mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
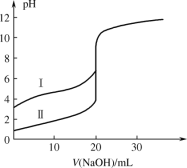
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COOH)>c(CH3COO-)
C.pH=7时,滴定盐酸消耗V(NaOH)大于醋酸消耗V(NaOH)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)═c(Cl-)
难度: 困难查看答案及解析
-
实验小组同学探究FeSO4分解反应并检验反应产物(加热及加持装置略)。下列有关FeSO4分解的说法不正确的是( )
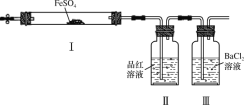
A.Ⅰ中固体变为红棕色,说明反应生成了Fe2O3
B.Ⅰ中反应需持续加热,说明FeSO4分解是吸热反应
C.Ⅱ中品红溶液颜色褪去,说明反应生成了SO2
D.Ⅲ中未产生白色沉淀,说明反应未生成SO3
难度: 中等查看答案及解析