-
为了配合防疫,我们尽量做到每天测量体温,普通体温计中含有金属汞(Hg)。关于
的说法错误的是( )
A.质子数为80 B.核外电子数为80
C.核电荷数为120 D.中子数为120
难度: 简单查看答案及解析
-
根据元素周期表和元素周期律,判断下列叙述正确的是( )
A.气态氢化物的稳定性:CH4˂SiH4
B.氢元素与另一种元素形成的化合物一定是共价化合物
C.如图所示实验证明元素的非金属性:C>Si
D.用中文“
”命名的第118号元素在周期表中位于第七周期VIII族
难度: 中等查看答案及解析
-
下列物质的晶体中,既含离子键,又含共价键的是( )
A.He B.Na2O2 C.H2O2 D.MgCl2
难度: 简单查看答案及解析
-
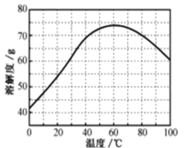
根据下列信息判断氢气燃烧生成水时的热量变化,下列说法正确的是( )
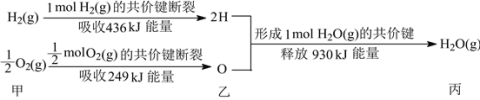
A.H2(g)与O2(g)反应生成1molH2O(g)时放出热量930kJ
B.H2O(g)分解为H2(g)与O2(g)时放出热量
C.图中甲、乙、丙中物质所具有的总能量大小关系为:乙>甲>丙
D.1molH2(g)和
molO2(g)的总能量小于1molH2O(g)的能量
难度: 中等查看答案及解析
-
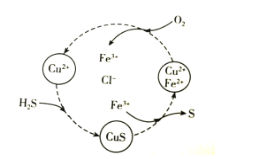
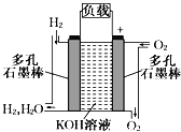
如图为番茄电池装置示意图,下列说法正确的是( )

A.铜片上发生还原反应
B.电流由锌片通过导线流向铜片
C.锌片质量减小,发生还原反应
D.番茄中的阳离子移向锌片
难度: 简单查看答案及解析
-
在2L恒容容器中进行制NH3的反应,相关数据如表。当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H2
2NH3
起始物质的量/mol
1.0
3.0
0
2秒末物质的量/mol
0.6
1.8
0.8
A.0.2mol/(L·s) B.0.4mol/(L·s) C.0.6mol/(L·s) D.0.8mol/(L·s)
难度: 简单查看答案及解析
-
一定温度下在密闭容器中,a mol SO2和b mol O2发生反应,达平衡时有c mol SO3生成,则在平衡混合气体中SO2所占的体积分数为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
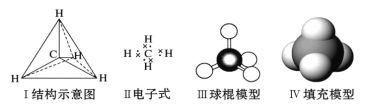
下列说法正确的是( )
A.C4H10的一氯代物有2种
B.正戊烷分子中所有的碳原子均在同一条直线上
C.可用溴水来除去甲烷中混有的少量乙烯
D.某烃的分子式为C3H6,符合通式CnH2n,故该分子一定属于烯烃
难度: 中等查看答案及解析
-
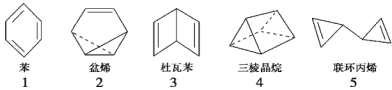
下列关于苯的叙述正确的是( )
A.从苯的结构简式
看,苯分子中含有碳碳双键
B.苯的分子式为C6H6,它能使酸性KMnO4溶液褪色
C.
的四氯代物有3种
D.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
难度: 中等查看答案及解析
-
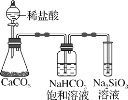
在实验室中,下列除杂的方法中正确的是( )
A.溴苯中混有溴,用CCl4萃取
B.CH4中混有C2H4,用酸性KMnO4溶液洗气
C.C2H6中混有C2H4,通入H2在一定条件下反应,使乙烯转化为乙烷
D.硝基苯中混有浓硫酸和浓硝酸,将其缓慢倒入NaOH溶液中,静置,分液
难度: 简单查看答案及解析
-
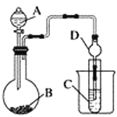
一定温度下,探究铜与稀HNO3的反应过程如图:

下列说法不正确的是( )
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
B.步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,打开止水夹,滴加稀硫酸,铜可以继续溶解
难度: 中等查看答案及解析
-
已知X、Y、Z、W为原子序数依次增大的短周期元素,Y、W为同一周期元素且W原子的最外层电子数等于Y原子的核外电子总数,其形成的一种化合物结构如图所示,下列叙述正确的是
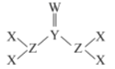
A.原子半径:W>Z>Y>X
B.该化合物中各元素的原子最外层均满足8电子结构
C.X与Y形成的二元化合物常温下一定为气态
D.X、Y、Z、W可形成原子个数比8:1:2:3的化合物
难度: 中等查看答案及解析