-
苏轼的《格物粗谈》中记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( )
A.甲烷 B.新戊烷 C.乙烯 D.苯
难度: 简单查看答案及解析
-
2019年7月1日起,全国多地陆续进入垃圾分类“强制时代”。下列说法不正确的是( )
A.废弃的聚乙烯塑料属于白色垃圾,不能使溴水褪色
B.汽车轮胎属于可回收垃圾,可以用煤和石油为原料通过分馏、干馏等化学变化制得
C.废旧电池中含有镍、镉等重金属,不能用填埋法处理
D.2020 年抗击“新冠病毒”战役中护理人员使用过的口罩要消毒、包装后交医疗废物处置中心处置,口罩中的无纺布主要成分聚丙烯属于混合物
难度: 中等查看答案及解析
-
生活中化学知识无处不在,下列化学知识的说法正确的是( )
A.在“新冠肺炎战疫”中,用于消毒的“84”消毒液的有效成分NaClO只含离子键
B.医用消毒酒精中乙醇的浓度为 75%,乙醇的官能团是-OH,1mol -OH 含 10mol 电子
C.可用于杀菌消毒的双氧水中过氧化氢的电子式为
D.用于衡量一个国家石油化工水平标志的乙烯结构简式为 CH2CH2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.
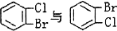 属于同分异构体
属于同分异构体B.分子式为 CH2Cl2 的物质共有 2 种结构
C.CH≡CH 和 CH2=CH-CH=CH2 互为同系物
D.
和
互为同分异构体
难度: 中等查看答案及解析
-
研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化。据此判断以下叙述中不正确的是( )
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.物质燃烧可看作是储存在物质内部的能量(化学能)转化为热能释放出来
C.氮气分子内部存在着很强的化学键,故通常情况下氮气的化学性质很活泼
D.需要加热才能发生的反应不一定是吸热反应
难度: 简单查看答案及解析
-
美国科学家发现,普通盐水在无线电波的照射下可以燃烧,这一发现将有望解决未来人类的能源危机。无线电频率可以降低盐水中所含原子之间的结合力,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是( )
A.共价键 B.离子键 C.静电斥力 D.静电引力
难度: 简单查看答案及解析
-
可再生能源是我国重要的能源资源,在满足能源需求、改变能源结构、减少环境污染、促进经济发展等方面具有重要作用。应用太阳能光伏发电技术是实现节能减排的一项重要措施。下列有关分析不正确的是( )
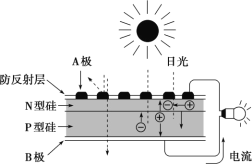
A.风能、太阳能等属于可再生能源
B.推广可再生能源有利于经济可持续发展
C.如图是太阳能光伏电池原理图,图中 A 极为正极
D.光伏电池能量转化方式是太阳能直接转化为电能
难度: 中等查看答案及解析
-
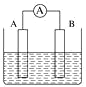
将纯锌和纯铜按如图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
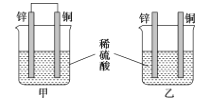
A.产生气泡的速率甲比乙快
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.两烧杯中铜片表面均有气泡产生
难度: 简单查看答案及解析
-
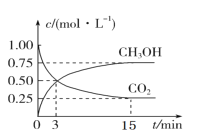
将
和
充入一容积为2L的密闭容器中(温度保持不变),发生反应
。测得
的物质的量随时间的变化如图中实线所示(图中字母后的数字表示对应的坐标)。该反应在1~3min内
的平均反应速率是( )
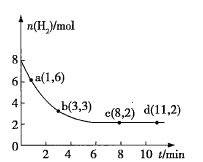
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在实验或生活中为了控制反应速率,下列做法不正确的是( )
A.用过氧化氢制取氧气时可加入少量的二氧化锰以加快反应速率
B.为加快制取氢气的速率可以用锌粒代替锌片
C.为降低浓硫酸与 Cu 反应制备 SO2 的速率可以采用稀硫酸代替浓硫酸
D.为了延长疫苗的保质期在运输和保存的过程中最好保持较低的温度
难度: 简单查看答案及解析
-
已知汽车尾气无害化处理反应为 2NO(g)+2CO(g)⇌N2(g)+2CO2(g),下列说法中不正确的是 ( )
A.当消耗 n mol CO,同时生成 n mol CO2 时反应达到平衡
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO 的反应速率保持恒定
D.当 CO 和 CO2 的物质的量之比保持不变时,反应达到平衡
难度: 简单查看答案及解析
-
用 NA 表示阿伏加德罗常数的值,下列说法正确的是( )
A.78 g 苯中含有的碳碳双键数目为 3 NA
B.1mol 甲烷和乙烯的混合气体与足量氧气充分反应生成的水分子数为 2 NA
C.标准状况下的 22.4 L CH4 和足量氯气在光照条件下充分反应生成 CCl4 分子数为 NA
D.在标准状况下,2.24 L 苯中所含分子数为 0.1NA
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.破坏乙烯分子里
所需吸收的能量是破坏乙烷分子里 C—C 能量的两倍
B.乙烯分子和苯分子都能使溴水褪色,两者褪色原理相同
C.因为甲烷和苯都不能被酸性 KMnO4 溶液氧化,所以两者都不能发生氧化反应
D.甲烷和苯都能和氯气发生取代反应,但是两者发生反应时需要的条件不同
难度: 中等查看答案及解析
-
下列由实验得出的结论正确的是( )
选项
实验
结论
A
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
发生加成反应,产物无色、可溶于四氯化碳
B
苯和溴水混合充分反应所得溶液分层,上层为橙红色
苯和所有的物质都不能发生加成反应
C
乙烯能使酸性高锰酸钾溶液褪色
可以用酸性高锰酸钾溶液除去乙烷中的乙烯,并得到干燥纯净的乙烷
D
甲烷与氯气在光照下反应后的混合气体能使湿润的蓝色石蕊试纸变红
生成的一氯甲烷具有酸性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2020 年春季抗击新冠肺炎中 N95 口罩成为“明星”,丙烯 CH3-CH=CH2 是制造 N95 口罩的原料。下列有关丙烯的说法错误的是( )
A.丙烯和乙烯互为同系物 B.丙烯能使酸性高锰酸钾溶液褪色
C.丙烯分子中所有的原子共面 D.丙烯与氢气的加成产物是饱和烃
难度: 简单查看答案及解析
-
天然气、石油和煤既是重要的化石燃料,也是重要的化工原料,下列有关说法中不正确的是 ( )
A.石油分馏实验中得到的各种分馏产物仍然是混合物
B.分馏得到的汽油和裂化得到的汽油都可以用来萃取溴水中的溴
C.煤的干馏、气化和液化都是通过化学变化提高资源利用率和减少污染
D.石油和煤都属于不可再生能源
难度: 简单查看答案及解析
-
下列各组中两个反应所属反应类型相同的是( )
A.光照甲烷和氯气的混合气体,气体颜色变浅;乙烯能使溴的四氯化碳溶液褪色
B.甲烷和氯气反应生成一氯甲烷;苯和液溴生成溴苯
C.乙烯能使溴水褪色;苯能使溴水褪色
D.用乙烯与氯化氢制取氯乙烷;用乙烷与氯气反应制取氯乙烷
难度: 简单查看答案及解析
-
如图是立方烷(cubane)的球棍模型,下列有关说法不正确的是( )
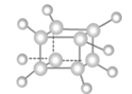
A.其分子式为 C8H8
B.其一氯代物只有一种同分异构体
C.立方烷可以使酸性高锰酸钾溶液褪色
D.它与苯乙烯(C6H5-CH=CH2)互为同分异构体
难度: 简单查看答案及解析
-
如图所示是四种常见有机物的比例模型示意图。下列说法不正确的是( )
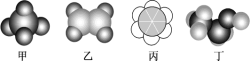
A.甲与丙烷互为同系物
B.乙可与溴水发生加成反应,也可以被酸性高锰酸钾溶液氧化
C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D.丁(CH3CH2OH)可由乙烯与水发生取代反应制得
难度: 简单查看答案及解析
-
某有机物其结构简式如图,关于该有机物,下列叙述不正确的是( )
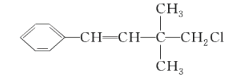
A.该物质分子中含有氯原子,不属于烃类
B.1 mol 该有机物能与溴的四氯化碳溶液发生加成反应反应,消耗 1 mol Br2
C.该物质与苯互为同系物
D.该物质在一定条件下,能发生加聚反应
难度: 简单查看答案及解析
-
如图所示,相等质量的铁和锌与足量的稀H2SO4充分反应,产生氢气的质量(m)与反应时间(t)的正确关系是
A.
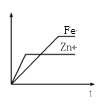 B.
B. 
C.
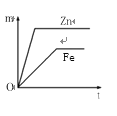 D.
D. 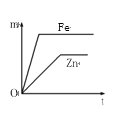
难度: 中等查看答案及解析
-
用稀硫酸与过量锌块反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施不可行的是( )
A.升高温度 B.改用等质量的锌粉
C.滴加少量硫酸铜溶液 D.滴加少量稀盐酸
难度: 简单查看答案及解析
-
可逆反应:2NO2(g)⇌2NO(g)+O2(g)在体积固定的恒温密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成 nmol O2的同时生成 2nmol NO2
②2v(NO) = v(O2)
③用NO2、NO、O2表示的反应速率的比为 2∶2∶1 的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
A.①④⑥ B.②③⑤ C.③④⑤ D.全部
难度: 中等查看答案及解析
-
将 A、B 置于固定容积为 1L 的密闭容器中,发生反应:3A(g)+B(g)⇌2C(g)+2D(g),反应进行到 10 s 末,测得 A 的物质的量为 1.8 mol,B 的物质的量为 0.6 mol,C 的物质的量为 0.8 mol,下列说法错误的是( )
A.用 C 表示 10 s 内反应的平均反应速率为 0.8 mol•L-1•s-1
B.反应前 A 的物质的量浓度是 3 mol•L-1
C.10 s 末,生成物 D 的物质的量为 0.8 mol
D.保持其他条件不变,适当升高温度,正逆反应速率都加快
难度: 中等查看答案及解析
-
制取 CH3CH2Cl 最好的方法是( )
A.乙烷与氯气发生取代反应 B.乙烯与氯气发生加成反应
C.乙烷与 HCl 发生取代反应 D.乙烯与 HCl 发生加成反应
难度: 简单查看答案及解析