-
某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:Ksp[ Al(OH)3]=1.0×10-34 Ksp[Fe(OH)3]=4.0×10 -38。已知::“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子,该离子会水解,下列说法不正确的是
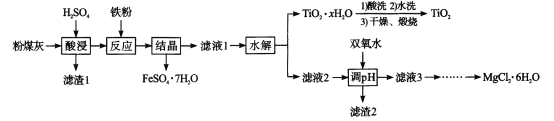
A.“酸浸”时TiO2发生反应的离子方程式为TiO2 +2H+= =TiO2+ +H2O
B.“结晶”时温度需控制在70℃以上,温度过低TiO2
xH2O产率降低
C.为使滤渣2沉淀完全,需“调pH"最小为4.3
D.MgCl2溶液制备MgCl2
6H2O需要在HCl的气氛下蒸发浓缩
难度: 中等查看答案及解析
-
有以下合成路线(部分反应条件已省略),下列有关说法错误的是
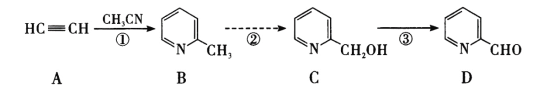
A.物质A的名称为乙炔,其电子式为
B.物质B中所有原子可能共平面
C.物质C的同分异构体中含有苯环且苯环上有两个取代基的有3种
D.反应③的反应条件为O2、Cu加热,反应类型为氧化反应
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期元素且原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,Y与W形成的阴离子(如图所示)中W不满足8电子稳定结构,W与Z的最高价之和为8。下列说法中错误的是
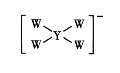
A.原子半径:Y>X>W
B.Z2O是某种弱酸的酸酐
C.W与X形成的二元化合物只能含极性键
D.最高价氧化物对应水化物的酸性:Z>X
难度: 中等查看答案及解析
-
探究金属与过量浓硫酸反应的装置(固定装置已略去)如下图所示。关于实验操作或叙述错误的是
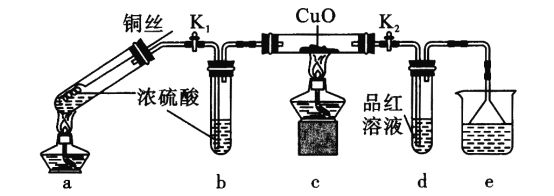
A.上下抽动铜丝,可控制反应随时发生或停止
B.e中可以选用NaOH溶液或酸性KMnO4溶液
C.其他条件不变,用铁丝代替铜丝,c、d中两次实验现象相同
D.为确定a中白色固体是否是硫酸铜,可向冷却后的试管中注入水,振荡后观察现象
难度: 困难查看答案及解析
-
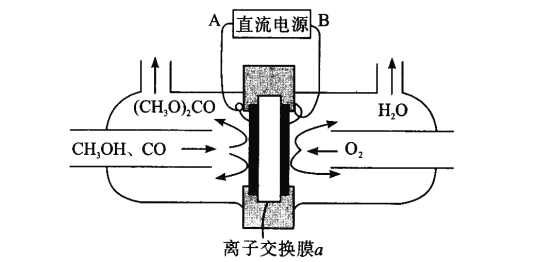
一种固定CO2的电化学装置如图,该电化学装置放电时可将CO2转化为Li2CO3和C,充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法正确的是
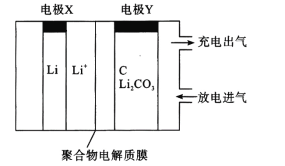
A.放电时,Li+向电极X方向移动
B.充电时,电极Y应与外接直流电源的负极相连
C.充电时,阳极的电极反应式为C +2Li2CO3-4e- =3CO2 ↑+4Li +
D.充电时,每转移0.4mol电子,理论上阳极生成标准状况下4.48LCO2
难度: 中等查看答案及解析
-
已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质
pH
NaF
7.5
Na2CO3
11.6
NaClO
9.7
NaHCO3
8.3
A.同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B.水解方程式:F-+H2O
HF+OH-的平衡常数为1×10-13
C.将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D.等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
难度: 困难查看答案及解析
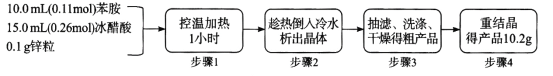

 b.
b.  c.
c. d.
d. 

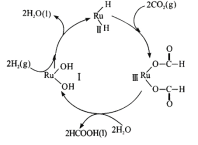
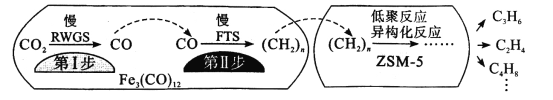
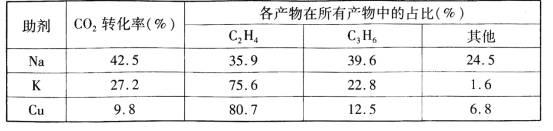
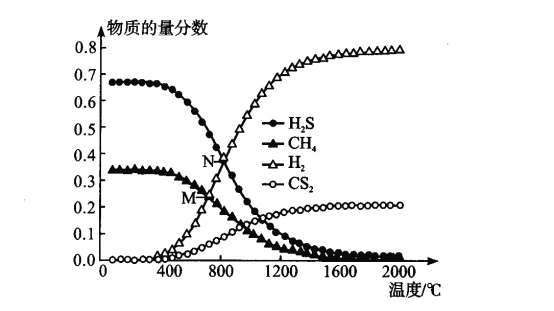
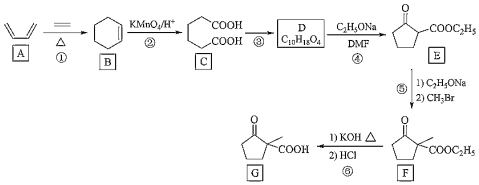
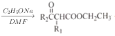 +CH3CH2OH
+CH3CH2OH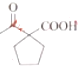 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。