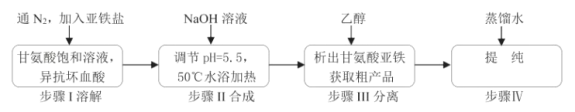
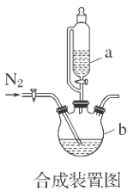
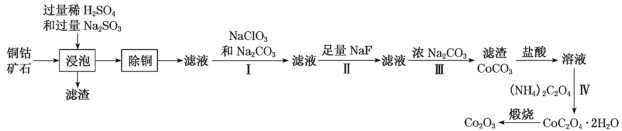
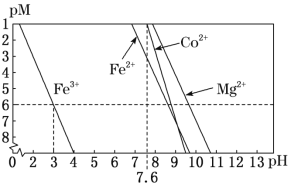
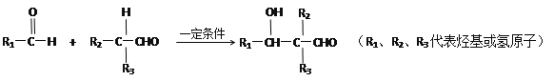
-
下列物质的用途与利用的性质对应关系不正确的是( )
A
B
C
D
物质
漂白液
碱石灰
铁红
单晶硅
主要成份
NaClO
氧化钙与氢氧化钠
Fe2O3
Si
用途
消毒剂
干燥剂
红色油漆或涂料
光导纤维
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
分子式为C5H12O的某醇,被氧化后能发生银镜反应,其同分异构体有( )
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
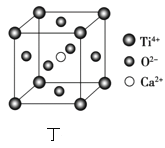
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。下列说法正确的是( )
X
Y
Z
W
T
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
D.YX2晶体熔化、液态WX3汽化均需克服分子间作用力
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.1.4gC2H4、C3H6 的混合气体中,所含碳原子总数为 0. lNA
B.1.0 mol CH4 与 Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0NA
C.标准状况下,22. 4LC2H6 中所含极性共价键的数目为 7NA
D.50mL l2mol·L 的浓盐酸与足量 MnO2 反应,转移电子总数为 0. 3NA
难度: 中等查看答案及解析
-
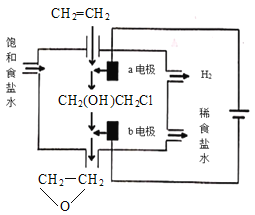
二甲醚(CH3OCH3)直接燃料电池具有启动快、效率高等优点,用二甲醚燃料电池电解甲基肼(CH3—NH—NH2)制氢的装置如图所示,其中X、Y、M、N均为惰性电极。下列说法正确的是( )
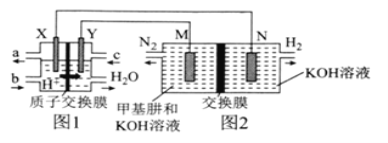
A.M极的电极反应式为CH3—NH—NH2+12OH--10e-=CO
+N2↑+9H2O
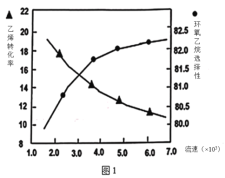
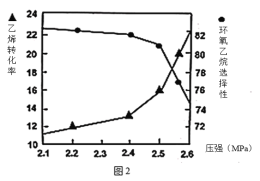
B.图1中电解质溶液的pH减小,图2中电解质溶液的pH增大
C.图2中的交换膜是阴离子交换膜,OH-透过交换膜向N极移动
D.理论上,当生成6.72LH2时,消耗CH3OCH3的质量为2.3g
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是( )
选项
实验操作
实验目的或结论
A
向废FeCl3蚀刻液X中加入少量的铁粉,振荡,未出现红色固体
X中一定不含Cu2+
B
向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成
说明Ksp(AgCl)>Ksp(AgI)
C
制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上
防止倒吸,便于分层
D
向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色
该溶液中一定含有Fe2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知AG=lg
,电离度α=
 ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。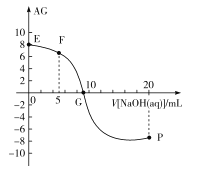
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
难度: 困难查看答案及解析