-
下列物质不能用作食品防腐剂的是
A.谷氨酸钠 B.亚硝酸钠 C.二氧化硫 D.苯甲酸
难度: 中等查看答案及解析
-
四苯乙烯可作发光材料,其结构简式如图所示。下列关于该化合物的说法错误的是
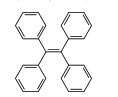
A.分子式为C26H20
B.一氯代物有3种
C.分子中所有原子可能共平面
D.能与溴的四氯化碳溶液发生取代反应
难度: 简单查看答案及解析
-
某研究小组将NaBO2、SiO2和Na的固体混合物与H2在500℃条件下制备NaBH4,实验装置如图所示。已知NaBH4中B为+3价,下列说法错误的是
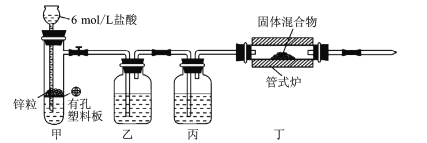
A.装置甲还可以用于制取CO2、H2S
B.装置乙、丙中分别装有NaOH溶液和浓硫酸
C.管式炉加热之前应收集装置尾部气体并验纯
D.可将反应后混合物加水溶解后用重结晶法提纯
难度: 中等查看答案及解析
-
我国科技工作者提出的一种OER(氧气析出反应) 机理如图所示。下列说法错误的是
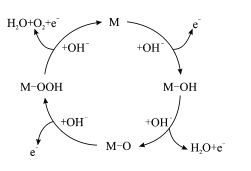
A.物质M不能改变OER反应的趋势
B.每一步反应过程都是氧化还原反应
C.反应过程中只涉及极性键的断裂和形成
D.该总反应方程式为4OH--4e-
2H2O+O2↑
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素,Y的一种氢化物可用作制冷剂,X、Z、W形成的化合物在农业上可作杀菌剂,结构如图。下列叙述正确的是
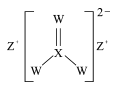
A.W的氧化物的水化物为强酸 B.最简单氢化物的沸点:W>Y>X
C.X与W形成的溶剂可溶解硫 D.Z与W形成的化合物仅含离子键
难度: 中等查看答案及解析
-
我国科技工作者设计了一种电解装置,能合成氨及硝酸,实现高效人工固氮,原理如图所示。下列说法正确的是
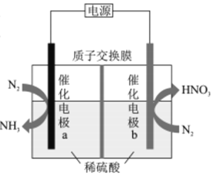
A.催化电极a的电势比催化电极b的电势高
B.负极区的电极反应为N2-10e-+6H2O=2NO3-+12H+
C.若N2得到6mole-,有6molH+向电极b迁移
D.理论上1molN2参与反应转移的电子数为3.75NA
难度: 中等查看答案及解析
-
在25℃时,用一定浓度NaOH溶液滴定醋酸溶液,滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)。下列说法正确的是
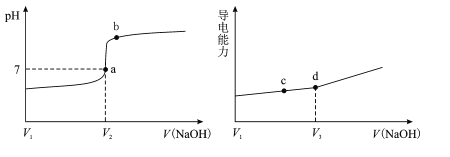
A.a→b过程中,水的电离程度不断增大
B.d点对应的溶液中:c(CH3COO-)+c(CH3COOH)=c(Na+)
C.c→d过程中,溶液导电性增强的主要原因是c(OH-)和c(Na+)增大
D.根据溶液pH和导电能力的变化可判断:V2>V3
难度: 困难查看答案及解析