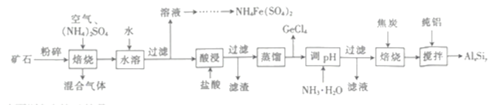
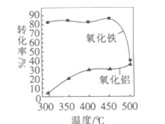
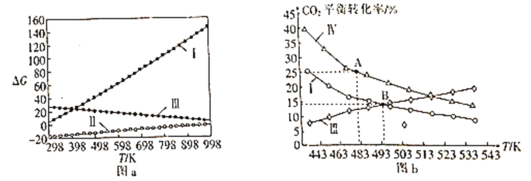
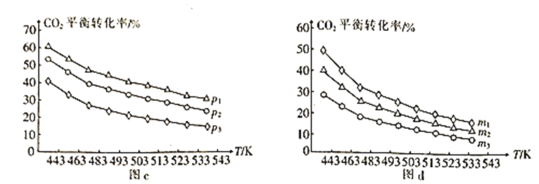
-
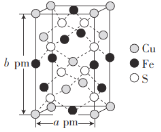
短周期主族元素W、X、Y、Z的原子序数依次增大,W、Y同主族,W、X、Y的最外层电子数之和与Z的最外层电子数相等,Y的族序数等于其周期数。下列说法错误的是( )
A.四种元素形成的单质中,Z的单质沸点最低
B.WZ3中W满足8电子稳定结构
C.Y、Z形成的化合物的水溶液呈酸性
D.X的氧化物可能既含离子键又含共价键
难度: 中等查看答案及解析
-
新冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成,核苷酸的单体由五碳糖、磷酸基和含氮碱基构成。下列说法错误的是
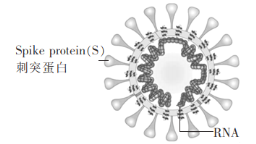
A.蛋白质和核酸均是高分子化合物
B.五碳糖(C5H10O5)与葡萄糖互为同系物
C.蛋白质中含C、H、O、N等元素
D.NaClO溶液用作消毒剂,是因为NaClO能使病毒蛋白变性
难度: 简单查看答案及解析
-
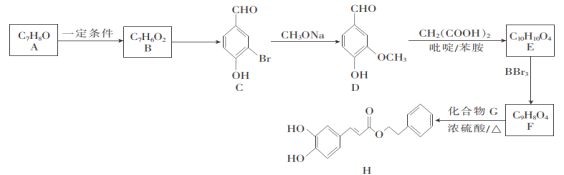
关于信息素N(结构如图所示),下说列法错误的是( )
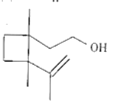
A.至少有6个碳原子一定共平面
B.能使少量酸性高锰酸钾溶液褪色
C.分子式为C11H20O
D.能发生酯化反应
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。关于常温下pH=5的NaH2PO4溶液,下列说法正确的是
A.溶液中含有的H+的数目为10-5NA
B.c(H+)+c(H3PO4)=c(OH-)+c(HPO
)
C.NaH2PO4溶液呈酸性是因为H2PO
发生了水解反应
D.加入pH=5的稀硫酸,溶液的酸性不变
难度: 中等查看答案及解析
-
海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包裹在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,则融化后的水为淡水。下列叙述正确的是
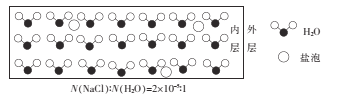
A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.每含1mol H2O的海冰内就有2×l0-5 NA个NaCl分子(NA为阿伏加德罗常数)
D.海冰内层NaCl的浓度约为l0-3 mol/L(设冰的密度为0.9 g.cm-3)
难度: 中等查看答案及解析
-
在一定条件下,如图所示装置可实现有机物的电化学储氢,将10 mol由苯和环已烷组成的混合气体通入反应器中,下列说法不正确的是
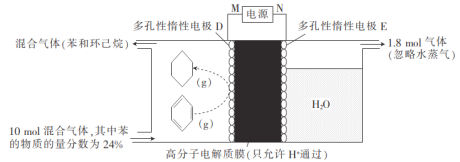
A.N为电源的正极
B.H+从右向左移动
C.D电极上的电极反应式为
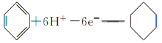
D.苯的转化率为50%
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀
原溶液中有Fe2+,无Fe3+
B
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
C
向碘水中加入等体积的CCl4,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
D
向某溶液中先加入Ba(NO3)2溶液,有白色沉淀生成;再加入足量盐酸,白色沉淀不消失
原溶液中一定含有SO
A.A B.B C.C D.D
难度: 简单查看答案及解析