-
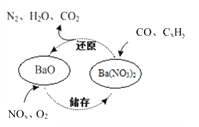
中国不少古诗词清晰地描绘了当时人民的生活和社会的发展,如刘禹锡的《浪淘沙》:“日照澄州江雾开,淘金女伴满江隈。美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识正确的是( )
A.“沙中浪底来”指的是金的氧化物
B.淘金原理与化学上的萃取一致
C.雾的分散质粒子直径范围是10-9~10-7cm
D.由沙子到计算机芯片发生了还原反应
难度: 简单查看答案及解析
-
氯化亚砜(
)是一种很重要的化学试剂,可以作为氯化剂和脱水剂。下列关于氯化亚砜分子的空间构型和中心原子(
)采取的杂化方式的判断正确的是( )
A.三角锥形、
B.
形、
C.平面三角形、
D.三角锥形、
难度: 中等查看答案及解析
-
下列有机物的系统命名正确的是
A.
: 3—甲基—2—乙基戊烷 B.
:3—甲基—2—丁烯
C.
: 2—甲基丁酸 D.
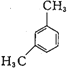 :1,5—二甲苯
:1,5—二甲苯难度: 中等查看答案及解析
-
下列有关溶液中离子存在和转化的表达合理的是( )
A.中性溶液中可能大量存在Fe3+、K+、Cl-、SO
B.离子方程式2Ca2++3HCO
+3OH-═2CaCO3↓+CO
+3H2O可以表示NH4HCO3与澄清石灰水反应
C.由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO
D.n[NH4Al(SO4)2]:n[Ba(OH)2]=2:5时发生的反应为NH
+Al3++2SO
+2Ba2++5OH-═NH3•H2O+AlO
+2H2O+2BaSO4↓
难度: 中等查看答案及解析
-
呋喃是最简单的含氧五元杂环化合物(其结构如图所示),有麻醉和弱刺激作用,极度易燃。下列关于呋喃的有关说法正确的是( )
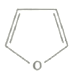
A.易溶于水和丙酮等有机溶剂
B.四个碳原子可能在同一平面上
C.一氯代物有2种,二氯代物有3种
D.生成1molC4H10O需标准状况下氢气44.8L
难度: 困难查看答案及解析
-
下列实验装置进行相应实验,能达到实验目的是( )
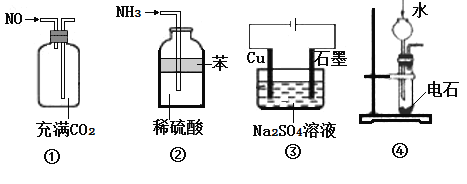
A.用图①所示装置(正放)可收集NO气体
B.用图②所示装置可吸收多余氨气且能防止倒吸
C.用图③所示装置可实现反应:Cu+2H2O
Cu(OH)2+H2↑
D.用图④所示装置可实现制乙炔
难度: 中等查看答案及解析
-
已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是
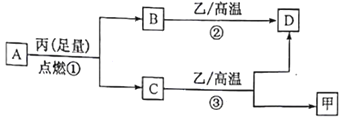
A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
难度: 中等查看答案及解析
-
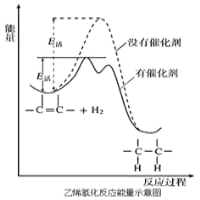
根据下列实验操作和现象所得出的结论错误的是
操作
现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状炭,并放出有刺激性气味的气体
浓硫酸具有脱水性和强氧化性
B
向盛有H2O2溶液的试管中加入几滴酸化的硫酸亚铁溶液
溶液变成棕黄色,一段时间后溶液中出现气泡,随后有红褐色沉淀生成
Fe2+催化H2O2分解产生O2
C
铝片先用砂纸打磨,再加入到浓硝酸中
无明显现象
浓硝酸具有强氧化性,常温下,铝表面被浓硝酸氧化为致密的氧化铝薄膜
D
向浓度均为0.1mol·L-1的KCl、KI的混合液中逐滴滴加稀AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
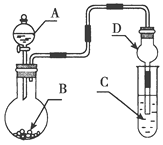
A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
难度: 中等查看答案及解析
-
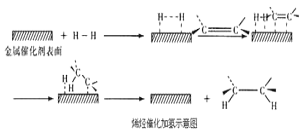
为研究废旧电池的再利用,实验室利用旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示。下列叙述错误的是
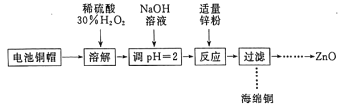
A. “溶解”操作中溶液温度不宜过高
B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的氧气或H2O2
C. 与锌粉反应的离子可能为Cu2+、H+
D. “过滤”操作后,将滤液蒸发结晶、过滤、洗涤、干燥后,高温灼烧即可得纯净的ZnO
难度: 中等查看答案及解析
-
氟离子电池是一种前景广阔的新型电池,其能量密度是目前锂电池的十倍以上且不会因为过热而造成安全风险。如图是氟离子电池工作示意图,其中充电时F-从乙电极流向甲电极,下列关于该电池的说法正确的是( )
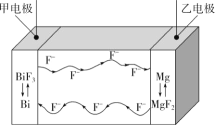
A.放电时,甲电极的电极反应式为Bi-3e-+3F-=BiF3
B.放电时,乙电极电势比甲电极高
C.充电时,导线上每通过1mole-,甲电极质量增加19g
D.充电时,外加电源的正极与乙电极相连
难度: 简单查看答案及解析
-
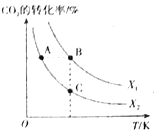
已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
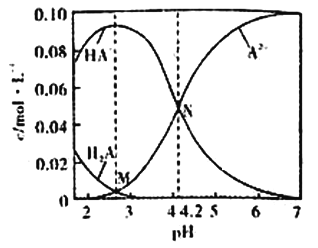
A.Ka2(H2A)的数量级为10-5
B.NaHA溶液中:c(H+)>c(OH-)
C.M点由水电离出的c(H+)>N点由水电离出的c(H+)
D.pH=7的溶液中:c(Na+)>2c(A2-)
难度: 困难查看答案及解析
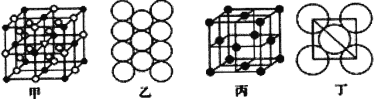

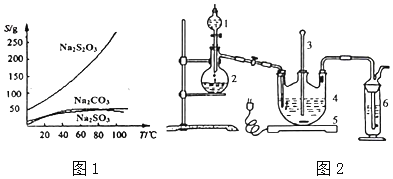
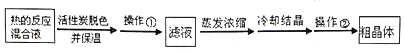
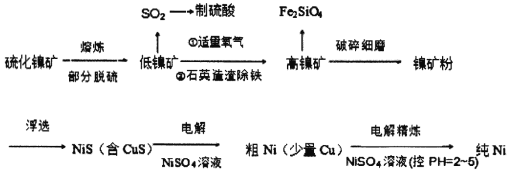
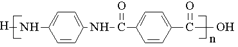 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: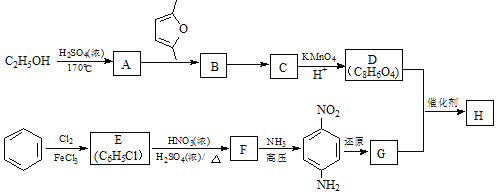
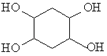 ,写出合成路线_______________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线_______________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。