-
下列关于元素周期表的说法正确的是( )
A.元素周期表有7个周期,8个主族 B.元素周期表有18个纵行,共16个族
C.短周期元素中可能有副族元素 D.元素周期表中的过渡元素就是副族元素
难度: 简单查看答案及解析
-
下列反应中,既属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2·8H2O与NH4Cl反应 B.铝热反应
C.H2与O2的燃烧反应 D.灼热的炭与CuO反应
难度: 简单查看答案及解析
-
Li和Na都是IA族元素,关于这两种元素的原子说法正确的是
A.原子半径:Li>Na B.核外电子数相同
C.核外电子层数相同 D.最外层电子数都相同
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.碳酸钠的电离方程式:Na2CO3═Na2++
B.氟原子的结构示意图:
C.
He和
He互为同素异形体
D.质子数为53,中子数为78的碘原子:
I
难度: 简单查看答案及解析
-
下列说法不正确的是
A.非金属元素的原子间不能形成离子化合物
B.Cl2、Br2、I2的分子间作用力依次增强,熔沸点依次升高
C.氯化氢气体溶于水共价键被破坏
D.100℃时水由液态变为气态,分子间作用力被破坏
难度: 简单查看答案及解析
-
从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是
A.碘升华 B.Cl2 溶于水 C.氯化钠受热熔化 D.酒精溶解于水
难度: 简单查看答案及解析
-
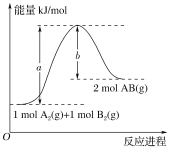
下列物质间的反应,其能量变化符合如图的是
A.碳酸钙的分解
B.灼热的炭与二氧化碳反应
C.铝热反应
D.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
难度: 简单查看答案及解析
-
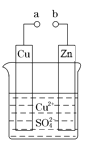
下列装置中,能构成原电池的是
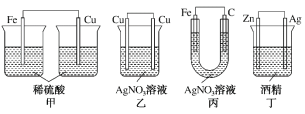
A.只有甲 B.只有乙
C.只有丙 D.除乙均可以
难度: 简单查看答案及解析
-
在一定条件下,反应N2+3H2
2NH3在10L恒容密闭容器中进行,测得2min内,H2的物质的量由20mol减少到8mol,则2min内NH3的化学反应速率为
A.0.4mol·(L·min)−1 B.1.8mol·(L·min)−1
C.1.2mol·(L·min)−1 D.0.6mol·(L·min)−1
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次递增,X原子的最外层电子数是内层电子数的3倍,X、W同主族。Y、Z是同周期相邻的两种元素,Y的最高价氧化物对应的水化物是一种两性化合物。下列判断正确的是
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.最简单气态氢化物的热稳定性:W>Z
C.Y元素的最高价氧化物对应的水化物既能与盐酸反应,也能与氨水反应
D.W元素的单质在暗处能与H2剧烈化合并发生爆炸
难度: 中等查看答案及解析
-
根据下表信息(部分短周期元素的原子半径及主要化合价)可知,下列叙述正确的是
元素代号
A
B
C
D
E
原子半径/nm
0.186
0.143
0.089
0.104
0.074
主要化合价
+1
+3
+2
+6、-2
-2
A.离子半径大小:
B.
与
的核外电子数不可能相等
C.最高价氧化物对应水化物的碱性:A<C
D.氢化物的稳定性:D>E
难度: 中等查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R的氢化物的水溶液可以用来刻蚀玻璃,则下列判断正确的是
A.气态氢化物的酸性:R>T>Q
B.R与Q的电子数相差16
C.气态氢化物的稳定性:T>X
D.R的单质通入T的钠盐溶液中能置换出T的单质
难度: 中等查看答案及解析
-
在2A+B=3C+4D反应中,表示该反应速率最快的是
A.v(A)=15mol·(L·min)−1 B.v(D)=1mol·(L·s)−1
C.v(C)=0.8mol·(L·s)−1 D.v(B)=18mol·(L·min)−1
难度: 简单查看答案及解析
-
人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH--2e- =ZnO+H2O,Ag2O+H2O+2e- =2Ag+2OH-。据此判断氧化银是
A.正极,被还原 B.负极,被氧化
C.正极,被氧化 D.负极,被还原
难度: 简单查看答案及解析
-
已知1molH-H的键能是akJ/mol,1molO=O键的键能是bkJ/mol,1molO-H键的键能是ckJ/mol,则下列关于2molH2(g)和1molO2(g)完全反应生成2molH2O(l)的说法正确的是
A.△H为正,△H=[(2a+b)-4c]kJ/mol B.△H为负,△H=[(2a+b)-4c]kJ/mol
C.△H为正,△H=[4c-(2a+b)]kJ/mol D.△H为负,△H=[4c-(2a+b)]kJ/mol
难度: 中等查看答案及解析
-
在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是
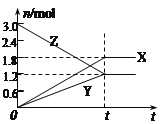
A.t时,X、Y、Z的质量不再改变
B.该反应的化学方程式为:3Z=3X+2Y
C.t时,Z的浓度为1.2mol/L
D.t时,反应停止,反应速率为0
难度: 中等查看答案及解析