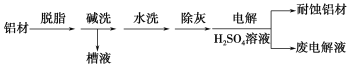
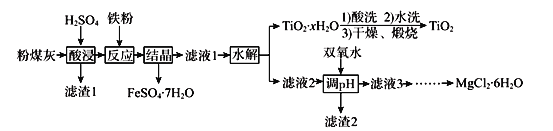
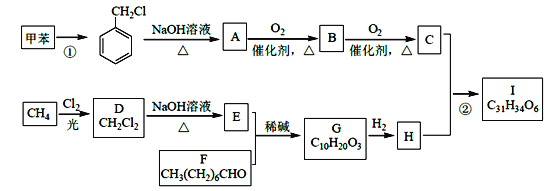
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 100mL1mol/LFeCl3溶液中所含Fe3+的数目为0.1NA
B. 将1mol Cl2通入水中,HClO、Cl-、ClO- 粒子数之和为NA
C. 12g乙烷中所含的极性共价键为2.4NA个
D. 标准状况下,4.48 LNO与足量氧气反应生成NO2数目为0.2NA
难度: 中等查看答案及解析
-
下列“实际应用”对应“化学知识原理”说法错误的是( )
选项
实际应用
化学知识原理
A
泡沫灭火器中装有碳酸氢钠溶液
和硫酸铝溶液
碳酸氢钠溶液和硫酸铝溶液水解且相互促进
B
工业上采用高压(20-50MPa)合成NH3
应用勒夏特列原理
C
施加石膏降低盐碱地(含Na2CO3)的碱性
CaCO3溶度积小于CaSO4
D
选用金属锂做电池电极材料
锂轻且在空气中稳定
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的有几个
①1molN2与4molH2反应生成的NH3分子数为2NA;
②标准状况下,体积为22.4L的SO3中含3NA个氧原子;
③1molC10H22分子中共价键总数为31NA;
④60g二氧化硅晶体中含有的分子数目为NA;
⑤1mol/LNaOH溶液中含有Na+数目为NA;
⑥1molD2O含10NA个电子;
⑦2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA。
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
下列有关分散系的叙述不正确的是
A.胶体是分散系的一种,它只是物质的一种存在形式
B.氢氧化铁胶体与三氯化铁溶液的本质区别是能否产生丁达尔效应
C.溶液的分散质可通过半透膜,而浊液的分散质则不能通过半透膜
D.工厂中的“静电除尘”利用了胶体的性质
难度: 简单查看答案及解析
-
最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。下列反应在类型上看可与该反应相比拟的是
A.CO2+H2O=H2CO3
B.NH3+HCl=NH4Cl
C.Zn+H2SO4=ZnSO4+H2↑
D.CH3COOH+NaOH=CH3COONa+H2O
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.
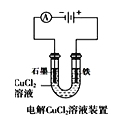 中阳极处能产生使湿润淀粉KI试纸变蓝的气体
中阳极处能产生使湿润淀粉KI试纸变蓝的气体B.
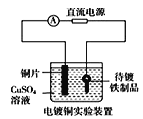 中待镀铁制品应与电源正极相连
中待镀铁制品应与电源正极相连C.
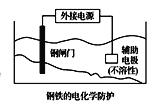 中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法D.
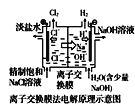 中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
中的离子交换膜可以避免生成的Cl2与NaOH溶液反应难度: 中等查看答案及解析
-
下列解释工业生产或应用的化学用语中,不正确的是( )
A. FeCl3溶液刻蚀铜电路板:2Fe3+ + Cu==2Fe2++ Cu2+
B. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O== Al(OH)3↓ + 3NH4 +
C. 将少量二氧化碳通入次氯酸钠溶液中:CO2+H2O+2ClO-== CO32-+2HClO
D. Na2CO3溶液处理水垢:CaSO4(s)+CO32−(aq)
CaCO3(s)+SO42−(aq)
难度: 中等查看答案及解析
-
中科院某课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法中正确的是( )
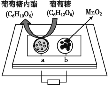
A. a极为正极
B. 随着反应不断进行,负极区的pH不断增大
C. b极电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D. 消耗0.01mol葡萄糖,电路中转移0.02mol电子
难度: 中等查看答案及解析
-
某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
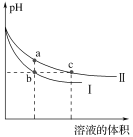
A. c点的溶液中c(OH−)+c(CH3COOH)=c(H+)
B. a、b两点溶液的导电性:a>b
C. b、c两点溶液中水的电离程度:b=c
D. 用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
难度: 困难查看答案及解析
-
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下图,
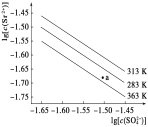
下列说法正确的是( )
A. 313K时,根据曲线计算可知Ksp(SrSO4) 数量级为10-5
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 283 K时,图中a点对应的溶液是饱和溶液
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
难度: 困难查看答案及解析
-
一种钌(Ru)配合物光敏太阳能电池工作原理及电池中发生的反应如下所示。下列说法正确的是( )

A.电极X为电池的正极
B.电池工作时,光能→化学能→电能
C.电池工作时,I-在电极Y上得电子
D.电池电解质溶液中I-和I3-的浓度不断减少
难度: 困难查看答案及解析
-
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
难度: 中等查看答案及解析
-
按图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.03g,则A合金中Cu、Zn原子个数比为( )
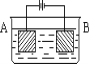
A. 4︰1 B. 3︰1 C. 2︰1 D. 任意比
难度: 中等查看答案及解析
-
H2RO3是一种二元酸,常温下用1L1mol·L-1Na2RO3溶液吸收RO2气体,溶液的pH随RO2气体的物质的量的变化如图所示。下列说法正确的是
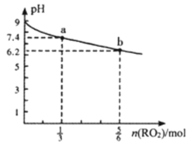
A.a点溶液中2c(Na+)=3c(RO32-)
B.向b点溶液中加水可使溶液的pH由6.2升高到7.4
C.常温下,NaHRO3溶液中c(HRO3-)>c(RO32-)>c(H2RO3)
D.当吸收RO2的溶液呈中性时,c(Na+)=c(RO32-)+c(HRO3-)
难度: 困难查看答案及解析