-
化学与科技、社会、生产密切相关,下列说法错误的是
A.港珠澳大桥钢筋表面的环氧树脂涂层属于合成高分子材料
B.“中国天眼”FAST用到的高性能碳化硅是一种新型的无机非金属材料
C.从石墨中剥离出的石墨烯薄片能导电,因此石墨烯是电解质
D.医用防护口罩中使用的聚丙烯熔喷布,其生产原料来自石油裂解
难度: 中等查看答案及解析
-
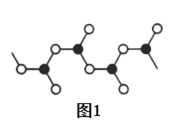
芳樟醇(
)是常用的香料,下列有关芳樟醇说法正确的是
A.能使酸性高锰酸钾溶液和溴水均褪色的原理不同
B.分子中所有碳原子共平面
C.与溴的CCl4溶液反应,产物仅有两种
D.与有机物
互为同系物
难度: 中等查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。图示装置和原理不合理的是
A.制取氨气
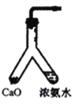 B.制取NaHCO3
B.制取NaHCO3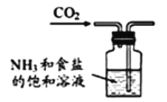
C.分离NaHCO3
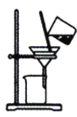 D.干燥NaHCO3
D.干燥NaHCO3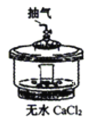
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.lmolC2H6O分子中含C-H键数目为0.5NA
B.1mol·L-1的NH4Cl溶液中含有NH4+数目小于0.1NA
C.25℃时,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.1molCl2与足量铜铁合金反应,转移电子数一定是2NA
难度: 中等查看答案及解析
-
2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。用太阳能电池给磷酸铁锂锂离子电池充电示意图如图所示,阳极反应式为:LiFePO4-xe-=xLi++Li1-xFePO4。下列叙述正确的是
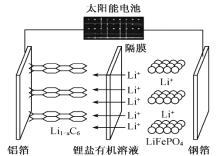
A.晶体硅能将太阳能转化为电能,太阳能电池属于原电池
B.该锂电池放电时负极反应为:LiC6-xe-=xLi++Li1-xC6
C.放电时,Li+通过隔膜向铝箔电极移动
D.磷酸铁锂锂离子电池充放电过程中,Fe、C、P元素化合价均不发生变化
难度: 中等查看答案及解析
-
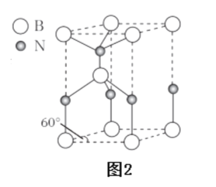
W、X、Y和Z为原子序数依次增大的四种短周期主族元素。X在短周期元素中原子半径最大,Y的最高正价与最低负价代数和为0,Z是所在周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如右图所示。下列叙述不正确的是

A.W和X形成的化合物的水溶液呈碱性
B.气态氢化物稳定性:Z>Y
C.右图化合物中W和Y均满足8电子稳定结构
D.可用pH试纸测定Z单质水溶液的pH
难度: 中等查看答案及解析
-
常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
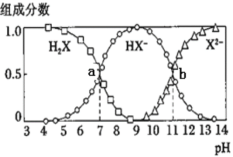
A.水的电离程度:b点小于点a
B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-
D.常温下,反应X2-+H2O⇌HX-+OH-的平衡常数对数值1gK=-11
难度: 中等查看答案及解析
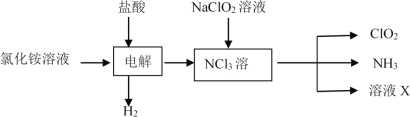
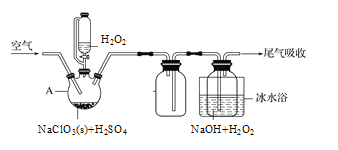
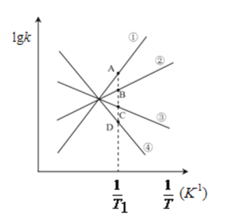
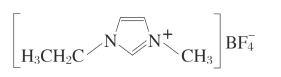
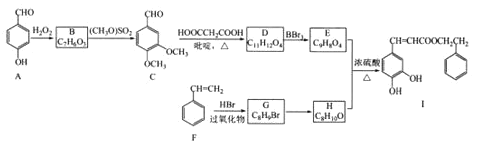
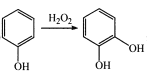 ;
;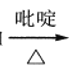 RCH=CHCOOH
RCH=CHCOOH