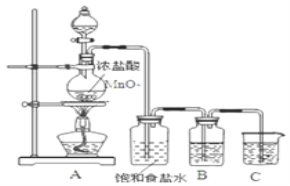
-
下列各组物质中化学键的类型完全相同的是( )
A.NaCl MgCl2 Na2O
B.H2O Na2O CO2
C.CaCl2 NaOH H2SO4
D.NH4Cl H2O CO2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.原子序数之差为2的两种元素不可能位于同一主族
B.位于同一主族相邻的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能是x+4
C.D‾ 核外有36个电子,则D元素位于第四周期第ⅦA族
D.位于同一周期的甲、乙两种元素,甲位于第ⅠA族,原子序数为x;乙位于第ⅢA族,则乙原子序数可能为x+19
难度: 中等查看答案及解析
-
下列化学用语不正确的是
A.氮分子的电子式
B.CO2的电子式:
C.NH4Cl的电子式:
D.用电子式表示HCl的形成过程

难度: 简单查看答案及解析
-
某兴趣小组设计的简易原电池装置如图所示。该电池工作时,下列说法正确的是
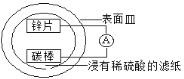
A.锌片作正极,发生还原反应
B.电子由碳棒经导线流向锌片
C.每有1molZn溶解,即有2NA的电子流经电解液
D.碳棒上有气泡产生
难度: 中等查看答案及解析
-
已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
反应A(g)+3B(g)⇌2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最小的是
A.v(A)=0.04mol/(L·s) B.v(B)=0.06mol/(L·s)
C.v(C)=0.05mol/(L·s) D.v(D)=0.02mol/(L·s)
难度: 简单查看答案及解析
-
下列有关化学反应速率的说法中,正确的是
A.实验室制取氢气时,将稀硫酸换为98%的浓硫酸,可加快反应速率
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.稀硫酸与氢氧化钠溶液反应时,增大压强可以加快反应速率
D.无论是吸热还是放热反应,加热都能加快化学反应速率
难度: 简单查看答案及解析
-
已知短周期元素的离子aA3+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>C B.离子半径 C3->D->B+>A3+
C.原子序数d>c>b>a D.A与B、C、D的最高价氧化物的水化物都能反应
难度: 中等查看答案及解析
-
下列说法中,正确的个数为
①共价化合物中不可能有离子键
②由非金属元素组成的化合物一定是共价化合物
③氯化钠的熔化与冰的融化所克服的粒子间相互作用相同
④液态水气化是一个吸热反应
⑤生石灰溶于水是一个放热的物理过程
⑥熔融状态能导电的化合物是离子化合物
⑦已知锑元素的相对原子质量为127.760,锑有两种以上天然同位素,则127.760是按照锑的各种天然同位素的质量数与这些同位素所占的原子百分比计算出来的平均值
A.1个 B.2个 C.3个 D.4个
难度: 简单查看答案及解析
-
短周期元素X和Y,可组成化合物X2Y3。当Y的原子序数为a时,X的原子序数可能是①a-3②a+5③a-8④a-1,其中正确的组合是
A.①③④ B.②③④ C.①②③ D.①②④
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如表:
元素代号
X
Y
Z
M
R
原子半径/nm
0.186
0.102
0.075
0.074
0.143
主要化合价
+1
+6、-2
+5、-3
-2
+3
已知X是短周期中最活泼的金属,且与R同周期。下列叙述不正确的是
A.离子半径大小:R3+<X+<M2-
B.因为M氢化物分子之间存在氢键,所以其氢化物为同主族氢化物中最稳定的
C.将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生
D.M氢化物的熔沸点高于Z氢化物的熔沸点
难度: 中等查看答案及解析
-
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
A.SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高
B.HCl水溶液为强酸,则HF水溶液也为强酸
C.Al既能与酸反应,又能与碱反应,则铊也既能与酸反应,又能与碱反应
D.同族元素有Ca(OH)2的碱性强于Mg(OH)2,Pb(OH)4的碱性也应强于Sn(OH)4
难度: 中等查看答案及解析
-
现有短周期主族元素X、Y、Z、R、T,R原子最外层电子数是电子层数的2倍,Z是金属元素,Y与Z能形成Z2Y、Z2Y2型化合物,Z与T形成化学式为Z2T的化合物,五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
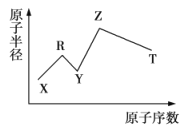
A.原子半径和离子半径均满足:
B.最高价氧化物对应的水化物的酸性:
C.简单氢化物的稳定性:
D.由X、Y、Z、T四种元素组成的化合物的水溶液一定呈中性
难度: 困难查看答案及解析
-
分析下图所示的三个原电池装置,其中结论正确的是( )
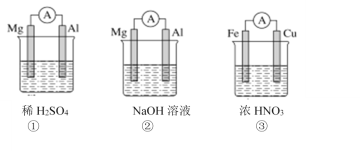
A.①②中Mg作负极
B.③中电流方向由Cu流向Fe
C.②中Mg作正极,电极反应式为2H2O+2e-=2OH-+H2↑
D.③中Cu作正极,电极反应式为2H++2e-=H2↑
难度: 中等查看答案及解析
-
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示。则下列对该反应的推断合理的是
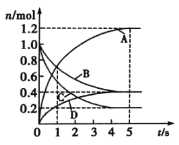
A.该反应的化学方程式为6A+2D
3B+4C
B.0~1s内,v(A)=v(B)
C.5s时,v(A)=v(B)=v(C)=v(D)
D.0~5s内,B的平均反应速率为0.06mol/(L·s)
难度: 中等查看答案及解析
-
通常人们把拆开1mol化学键吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热.下列是一些化学键的键能.
化学键
C﹣H
C﹣F
H﹣F
F﹣F
键能/(kJ•mol﹣1)
414
489
565
155
根据键能数据估算反应CH4+4F2═CF4+4HF每消耗1molCH4的热效应( )
A. 放热1940kJ B. 吸热1940kJ C. 放热485kJ D. 吸热485kJ
难度: 简单查看答案及解析
-
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O===2Ag+Zn(OH)2,下列说法中不正确的是
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH−−2e−===Zn(OH)2
C.工作时,负极区溶液c(OH−)减小
D.溶液中OH−向正极移动,K+、H+向负极移动
难度: 中等查看答案及解析
-
一种用于驱动潜艇的液氨
液氧燃料电池原理示意如图,下列有关该电池说法正确的是
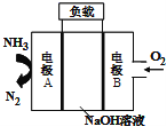
A.该电池工作时,每消耗22.4LNH3转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,OH-向电极B移动
D.电极B上发生的电极反应为:
H2O
难度: 简单查看答案及解析