-
X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
A. HX B. H2X C. XH4 D. XH3
难度: 中等查看答案及解析
-
下列离子中半径最大的是( )
A.Na+ B.Mg2+ C.O2- D.F-
难度: 简单查看答案及解析
-
根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2kJ·mol-1
2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3kJ·mol-1
判断Q1、Q2、Q3三者关系正确的是(
A.Q1>Q2>Q3 B.Q1>Q3>Q2 C.Q3>Q2>Q1 D.Q2>Q1>Q3
难度: 中等查看答案及解析
-
下列有关能源的说法不正确的是
A.光电转换的基本装置就是太阳能电池,应用相当广泛
B.利用蓝绿藻等低等植物和微生物在阳光作用下可使水分解产生氢气
C.贮氢合金的发现和应用,开辟了解决氢气贮存、运输难题的新途径
D.煤、石油、天然气、氢能中,天然气、氢能是可再生能源
难度: 中等查看答案及解析
-
下列各组物质含有的化学键类型完全相同的是:
A.NaOH、CaCl2、CaO B.Na2O、Na2O2、Na2S
C.NaCl、HCl、H2O D.HBr、CO2、NH3
难度: 简单查看答案及解析
-
下列有关性质的比较,不能用元素周期律解释的是
A.酸性;H2SO4>H3PO4
B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2
D.热稳定性:Na2CO3>NaHCO3
难度: 简单查看答案及解析
-
13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,瑞士科学家库尔特、维特里希等人为此获得2002年诺贝尔化学奖。下列有关13C、15N的叙述正确的是( )
A.15N与14N互为同位素 B.13C与C60互为同素异形体
C.13C、15N具有相同的中子数 D.15N的核外电子数与中子数相同
难度: 简单查看答案及解析
-
下列有关化学用语的表示错误的是( )
A.次氯酸的电子式为
B.
有a个电子、b个中子,R的原子符号为
C.用电子式表示
的形成过程为
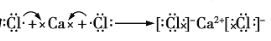
D.
的结构示意图为
难度: 中等查看答案及解析
-
已知NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.CO2、CCl4中所有原子均达到最外层8电子稳定结构
B.18 g H2O和18 g D2O的质子数都为10NA
C.78 g Na2O2中所含离子的数目为4NA
D.KHSO4溶于水的过程中只有离子键断裂
难度: 简单查看答案及解析
-
下列说法中,不符合第ⅦA族元素性质特征的是( )
A.易形成-1价离子 B.从上到下原子半径逐渐减小
C.最高价氧化物的水化物显酸性 D.从上到下氢化物的稳定性依次减弱
难度: 简单查看答案及解析
-
在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
难度: 中等查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如图。已知B、C两元素在周期表中族序数之和是A元素序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C所在的一组是( )
A.Be、Na、Al B.B、Mg、Si C.O、P、Cl D.C、Al、P
难度: 简单查看答案及解析
-
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.c的一种氧化物可以给自来水杀菌消毒
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
难度: 简单查看答案及解析
-
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol
B.2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C.2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D.H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
难度: 简单查看答案及解析
-
中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。下列说法不正确的是( )
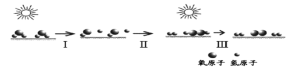
A.整个过程实现了光能向化学能的转换
B.过程Ⅱ有O-O单键生成并放出能量
C.过程Ⅲ发生的化学反应为:2H2O2 ═ 2H2O + O2↑
D.整个过程的总反应方程式为:2H2O ═ 2H2↑ + O2↑
难度: 中等查看答案及解析
-
下列实验操作能够达到实验目的的是
测定中和热
用石灰石和稀盐酸制取CO2
蒸馏石油
配制溶液中转移溶液
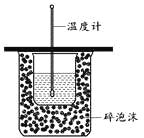
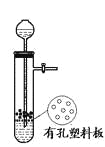
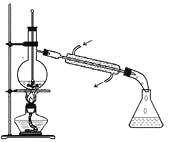
A
B
C
D
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
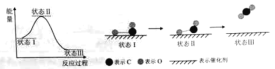
某反应由两步反应A
B
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是( )
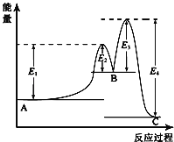
A.三种化合物的稳定性顺序:B﹤A﹤C B.两步反应均为放热反应
C.加入催化剂会改变反应的焓变 D.A
C的反应的ΔH=E1-E2
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的 稀溶液混合,则放出的热量大于57.3 kJ
难度: 中等查看答案及解析
-
下列关于反应能量的说法正确的是( )
A.若反应A=B △H<0,说明A物质比B物质稳定,分子内共价键键能 A比B大
B.Zn(s)+CuSO4 (aq)==ZnSO4 (aq) +Cu(s) △H= -216 kJ·mol-1。则反应物总能量>生成物总能量
C.101kPa时,2H2(g)+O2(g)==2H2O(g) △H= -Q kJ·mol-1,则H2的燃烧热为1/2Q kJ·mol-l
D.H+(aq) +OH- (aq)=H2O(l) △H= -57.3 kJ·mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol CH3COOH的醋酸溶液混合后会放出57.3 kJ的热量
难度: 中等查看答案及解析
-
已知热化学方程式:
① C2H2(g) +
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ•mol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJ•mol-1
③ H2(g)+
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为( )
A.+228.2 kJ·mol-1 B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1 D.+621.7 kJ·mol-1
难度: 简单查看答案及解析
-
N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )
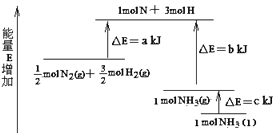
A.N2(g)+3H2(g)=2NH3(l) △H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)=2NH3(g) △H=2(b-a)kJ/mol
C.1/2 N2(g)+3/2H2(g)=NH3(l) △H=(b+c-a)kJ/mol
D.1/2 N2(g)+3/2H2(g)=NH3(g) △H=(a+b)kJ/mol
难度: 中等查看答案及解析