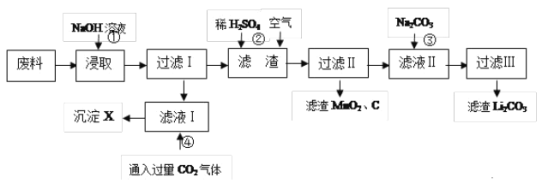
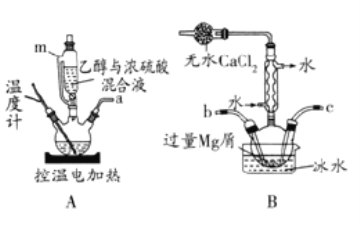
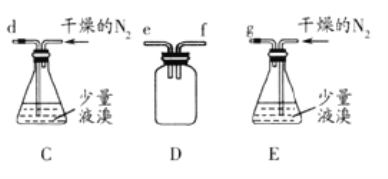
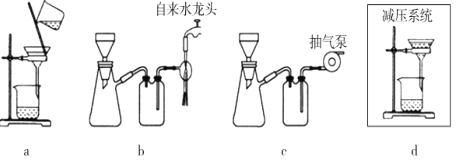
-
从古至今化学与生产、生活密切相关。下列说法不正确的是( )
A.我国从四千余年前开始用谷物酿造出酒和醋,酿造过程中只发生水解反应
B.我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造机钛合金结构件;高温时可用金属钠还原相应的氯化物来制取金属钛
C.李兰娟院士在记者会上透露:“新冠病毒怕酒精,不耐高温,56℃持续30分钟,病毒就死亡”。这里有蛋白质的变性
D.垃圾分类很重要,充电电池和硒鼓墨盒都属于有害垃圾
难度: 中等查看答案及解析
-
乙苯和二氧化碳反应生成苯乙烯的过程如图所示。下列说法不正确的是(NA为阿伏加德罗常数的值)( )
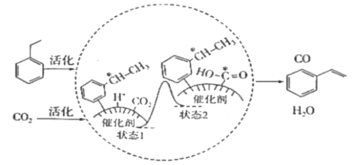
A.10.6g乙苯中所含的极性共价键数目为1.0NA
B.增加二氧化碳的浓度,可能提高苯乙烯的产率
C.状态1到状态2有氧氢键形成
D.标准状况下,10.4g苯乙烯中所含的电子数目为4.0NA
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.二环己烷(
)的二氯代物有6种结构(不考虑立体异构)
B.环己烯(
)可以发生加成反应、加聚反应、取代反应、氧化反应。
C.分子式为C5H10O2,且属于酯的同分异构体共有8种(不考虑立体异构)
D.葡萄糖和果糖互为同系物
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,W的单质为常见的半导体材料,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断正确的是( )
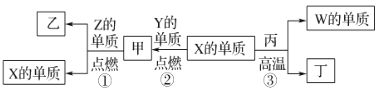
A.X的氢化物沸点低于Y的氢化物沸点
B.W的单质可以用作计算机芯片,太阳能电池,丙是玛瑙的主要成分
C.甲、丙、丁均为酸性化合物
D.工业上用X的单质和乙来制取Z单质
难度: 中等查看答案及解析
-
下列实验操作、现象及所得出的结论或解释均正确的是( )
选项
实验操作
现象
结论或解释
A
向次氯酸钙溶液中通入二氧化硫
产生白色沉淀
酸性:H2SO3>HClO
B
向废FeCl3蚀刻液X中加入少量的铁粉,振荡
未出现红色固体
X中一定不含Cu2+
C
向饱和硅酸钠溶液中加入浓盐酸
产生白色沉淀
制取硅酸胶体
D
铬酸钠溶液中加入浓硫酸
溶液由黄色变为橙色
氢离子浓度对该反应的化学平衡有影响
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
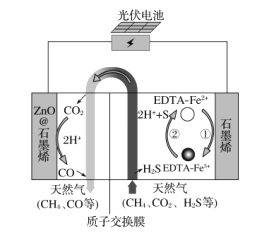
该装置工作时,下列叙述正确的是( )
A.电子从ZnO@石墨烯极移到石墨烯极,电解质中的阳离子向石墨烯极移动
B.光伏电池中使用二氧化硅把光能转为化学能
C.协同转化总反应:CO2+H2S=CO+H2O+S
D.石墨烯上的电势比ZnO@石墨烯上的低
难度: 中等查看答案及解析
-
20℃时,用0.1mol/L盐酸滴定20mL0.1mol/L氨水的图像如图所示,下列说法正确的是( )
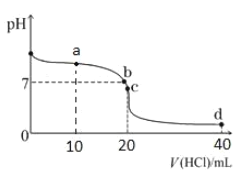
A.a点时c(Cl-)=2c(NH3∙H2O)+2c(NH
)
B.b点表示酸碱恰好完全反应
C.c点时c(NH
)>c(Cl-)>c(H+)>c(OH-)
D.a、b、c、d均有c(NH
)+c(H+)=c(Cl-)+c(OH-)
难度: 中等查看答案及解析