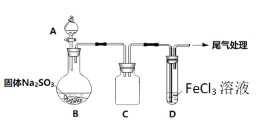
-
下列装置工作时,将电能转化为化学能的是( )
A.风力发电
 B.电解氯化铜溶液
B.电解氯化铜溶液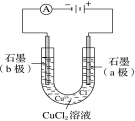
C.南孚电池放电
 D.天然气燃烧
D.天然气燃烧
难度: 简单查看答案及解析
-
下列物质属于弱电解质的是( )
A.H2O B.NaOH C.NaCl D.H2SO4
难度: 简单查看答案及解析
-
准确量取25.00 mL酸性高锰酸钾溶液,可选用的仪器是( )
A.500 mL量筒 B.10 mL量筒
C.50 mL碱式滴定管 D.50 mL酸式滴定管
难度: 简单查看答案及解析
-
控制变量是科学研究的重要方法。相同质量的铝与足量1 mol·L-1盐酸分别在下列条件下发生反应,开始阶段化学反应速率最大的是( )
选项
铝的状态
实验温度/℃
A
片状
20
B
片状
30
C
粉末
20
D
粉末
30
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.碳酸氢钠溶液和盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与二氧化碳反应 D.甲烷在氧气中的燃烧反应
难度: 简单查看答案及解析
-
下列操作中,能使电离平衡H2O⇌H++OH-,向逆反应反向移动的是( )
A.向水中加入2.0mol/L碳酸钠溶液 B.向水中加入2.0mol/L 氢氧化钠溶液
C.向水中加入2.0mol/L 氯化钠溶液 D.将水加热到100℃,使pH=6
难度: 简单查看答案及解析
-
将1molN2和3molH2充入某固定体积的密闭容器中,在一定条件下,发生反应N2(g)+3H2(g)⇌2NH3(g)ΔH<0并达到平衡,改变条件,下列关于平衡移动说法中正确的是( )
选项
改变条件
平衡移动方向
A
使用适当催化剂
平衡向正反应方向移动
B
升高温度
平衡向逆反应方向移动
C
再向容器中充入1molN2和3molH2
平衡不移动
D
向容器中充入氦气
平衡向正反应方向移动
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污 B.明矾KAl(SO4)2•12H2O净化水
C.加热氯化铁溶液颜色变深 D.钢铁在潮湿的环境下生锈
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.合成氨时使用催化剂,可提高氨气的平衡产率
B.某些不能自发进行的氧化还原反应,通过电解可以实现。
C.C(s、石墨)=C(s、金刚石) △H=+1.9 kJ•mol-1,则等质量的石墨比金刚石能量高
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
难度: 中等查看答案及解析
-
解释下列事实所用的方程式不正确的是( )
A.碳酸氢钠在水溶液中的电离:NaHCO3=Na++HCO
B.硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ = 2I2+2H2O
C.用热的纯碱溶液清洗油污:CO
+ 2H2O⇌H2CO3 + 2OH-
D.用Na2CO3溶液处理锅炉水垢中的硫酸钙:CO
+ CaSO4 =CaCO3 + SO
难度: 中等查看答案及解析
-
常温下,某溶液由amol/LCH3COONa和bmol/LCH3COOH组成的混合液,下列说法中正确的是( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液一定呈中性 D.CH3COONa会抑制CH3COOH的电离
难度: 中等查看答案及解析
-
已知:N2O4(g)⇌2NO2(g) ΔH>0,现将1molN2O4充入2L密闭容器中,下列说法中不能说明反应达到平衡状态的是( )
A.N2O4质量不再变化
B.NO2浓度不再发生变化
C.混合气体的总质量不再变化
D.NO2的消耗速率是N2O4消耗速率的2倍
难度: 中等查看答案及解析
-
下列各种变化属于原电池反应的是( )
A.在空气中金属铝表面迅速氧化形成保护层
B.工业上用饱和的食盐水制备氯气和烧碱
C.锌与稀硫酸反应时,加入少量的硫酸铜溶液,可加快反应速率
D.铜在空气中加热变黑,趁热立即插入无水乙醇中又变红
难度: 中等查看答案及解析
-
已知: (1)Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s),ΔH=+234.1kJ•mol-1
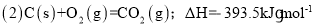 则
则的ΔH是( )
A.-824.4 kJ•mol-1 B.-627.6kJ•mol-1 C.-744.7kJ•mol-1 D.-169.4kJ•mol-1
难度: 中等查看答案及解析
-
关于下图所示的原电池,下列说法正确的是( )
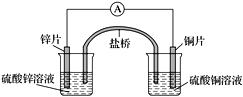
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
难度: 中等查看答案及解析
-
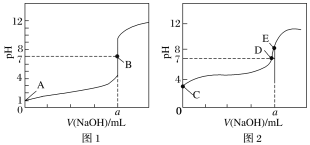
常温下,向20 mL 0.1 mol·L-1氨水中滴加0.1 mol·L-1盐酸,溶液中由水电离出的c(H+)随加入盐酸体积的变化如图所示。则下列说法正确的是( )
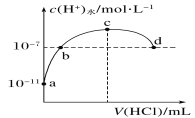
A.c点溶液中,c(NH
)=c(Cl-)
B.a、b之间的任意一点:c(Cl-)>c(NH
)>c(H+)>c(OH-)
C.b、d两点溶液pH均为7
D.b、c、d任意一点都有: c(NH
)+c(H+)=c(OH-)+ c(Cl-)
难度: 中等查看答案及解析