-
下列有关海水综合利用的说法正确的是
A. 利用电解的方法可以从海水中获取淡水
B. 海水中含有钾元素,只需经过物理变化可以得到钾单质
C. 海水蒸发制海盐的过程只发生了化学变化
D. 从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
难度: 中等查看答案及解析
-
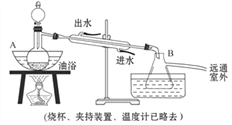
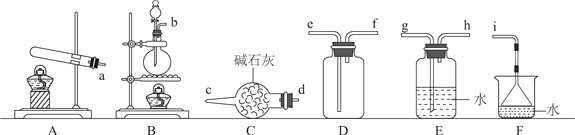
下列有关实验室制取蒸馏水的实验装置与操作的说法中,错误的是( )
A. 冷凝管中水流方向是从下口进入,上口排出
B. 温度计的水银球应插入蒸馏烧瓶的自来水中
C. 实验中需要在烧瓶中加入几粒碎瓷片,防止出现暴沸现象
D. 蒸馏烧瓶必须垫加石棉网加热
难度: 简单查看答案及解析
-
提出元素周期律并绘制了第一张元素周期表的化学家是( )
A. 戴维 B. 侯德榜 C. 道尔顿 D. 门捷列夫
难度: 简单查看答案及解析
-
下列分离方法错误的是( )
A.除去混在植物油中的水——倾倒 B.除去粗盐中的泥沙——过滤
C.用乙醚提取中草药中的有效成分——萃取 D.除去氯气中的氯化氢气体——洗气
难度: 简单查看答案及解析
-
下列实验操作正确的是( )
编号
实验
操作
A
制备氢氧化铝凝胶
向氯化铝溶液中加入过量的氢氧化钠溶液
B
配制一定浓度的氯化钾溶液100mL
将称好的氯化钾固体放入100 mL容量瓶中,加水溶解,振荡摇匀,定容
C
灼烧铝片
将金属铝表面用砂纸仔细打磨,除去氧化膜后,在酒精灯火焰上灼烧,有液态铝滴落
D
制备Fe(OH)3胶体
向盛有沸水的烧杯中滴加饱和FeCl3溶液,继续加热至溶液呈现红褐色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.H2S的电子式:
B.S2-结构示意图:
C.Na2O2的电子式:
D.CCl4的电子式:
难度: 简单查看答案及解析
-
0.05mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
A. 第三周期、ⅠA族 B. 第三周期、ⅡA族
C. 第四周期、ⅠA族 D. 第四周期、ⅡA族
难度: 中等查看答案及解析
-
如下图所示每条折线表示周期表IVA〜VII中的某一族元素氢化物,其中a点代表的是
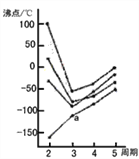
A. H2S B. HCl
C. PH3 D. SiH4
难度: 中等查看答案及解析
-
已知反应A+B= C+D的能量变化如下图所示,下列说法正确的是
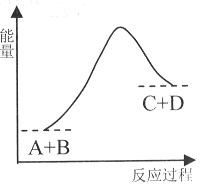
A.该反应是放热反应
B.只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量
难度: 简单查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
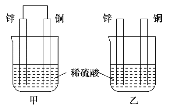
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
难度: 中等查看答案及解析
-
在下列过程中,需要加快反应速率的是( )
A. 食物变质 B. 合成氨 C. 钢铁腐蚀 D. 塑料老化
难度: 简单查看答案及解析
-
锌与过量的稀盐酸反应,为了加快反应速率,又不影响生成氢气的总量,可以采取的措施是( )
A. 加入浓盐酸 B. 加入一定量CuSO4固体 C. 加入适量的水 D. 降低温度
难度: 简单查看答案及解析
-
下列表示的是化学反应 A+2B=C+D 在不同条件下的反应速率,其中最快的是
A.v(A)=0.3mol∙L-1∙s-1 B.v(B)=0.5mol∙L-1∙s-1
C.v(C)=0.25mol∙L-1∙s-1 D.v(D)=0.2mol∙L-1∙s-1
难度: 中等查看答案及解析
-
在一定条件下,对于密闭容器中进行的可逆反应:H2(g)+I2(g)
2HI(g),达到化学平衡状态的标志是( )
A. 正、逆反应速率都等于零 B. H2、I2的浓度相等
C. HI、H2、I2在容器中共存 D. HI、H2、I2的浓度均不再变化
难度: 中等查看答案及解析
-
下列不属于高分子化合物的是( )
A. 纤维素 B. 聚氯乙烯 C. 淀粉 D. 油脂
难度: 简单查看答案及解析
-
下列变化属于物理变化的是( )
A. 石油分馏 B. 煤的液化 C. 蛋白质变性 D. 石油裂化
难度: 简单查看答案及解析
-
下列各组有机物中,仅使用溴水不能鉴别出的是( )
A.苯、四氯化碳 B.乙炔、乙烯 C.乙烷、乙烯 D.苯、酒精
难度: 中等查看答案及解析
-
用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
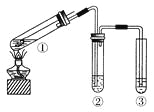
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
难度: 中等查看答案及解析
-
O3在水中易分解。一定条件下,起始浓度均为0.0216mol/L的O3溶液,在不同的pH、温度下,发生分解反应,测得O3浓度减少一半所需的时间(t)如下表所示:
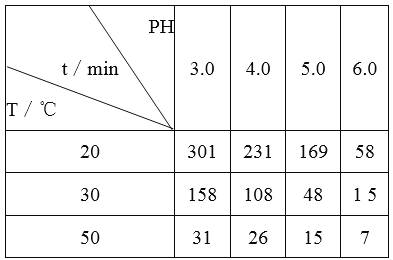
下列判断不正确的是
A. 实验表明,升高温度能加快O3的分解速率
B. pH增大能加速O3分解,表明OH-可以对O3的分解起催化作用
C. 在30℃、pH=4.0时,O3的分解速率为1.00×10-4mol/(L·min)
D. 据表中的规律可推知,O3在下列条件下的分解速率v(40℃、pH=3.0)>v(30℃、pH=7.0)
难度: 困难查看答案及解析