-
将一定质量的铜与150mL的一定浓度的硝酸反应,铜完全溶解,产生标准状况下11.2L的NO和NO2的混合气体,将生成的混合气体与5.6L标况下的氧气一起通入足量NaOH溶液中,气体恰好被吸收生成NaNO3。下列说法不正确的是( )
A.铜的质量为32g
B.标准状况下,混合气体构成是5.6L的NO和5.6L的NO2
C.硝酸的物质的量浓度为10.0mol˙L-1
D.向反应后的溶液加NaOH,使铜沉淀完全,需要NaOH的物质的量至少为1.0mol
难度: 中等查看答案及解析
-
下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.4000 mol·L−1的NaOH溶液
称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取纯净氢气
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液
D
探究浓度对反应速率的影响
向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与人类的生活息息相关,下列有关说法正确的是
A.食品添加剂对于改善食品外观、防止食品腐败具有重要作用
B.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
C.纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物
D.泰国银饰和土耳其彩瓷是“一带一路” 沿线国家特色产品,其主要成分均属于金属材料
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA,下列说法正确的是
A.标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B.1mol Na2O2与足量CO2充分反应,转移的电子数为2 NA
C.25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D.0.1 mol H2和0.1 molI2于密闭容器中充分反应后,HI分子总数为0.2NA
难度: 困难查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.在pH=7的溶液中:Fe3+、K+、Cl-、SO
B.滴加KSCN溶液显红色的溶液中:NH
、K+、Cl-、I-
C.c(OH-)/c(H+)=10-12的溶液中:NH
、Cu2+、NO
、SO
D.水电离产生的c(OH-)=10-12 mol·L-1的溶液中:Na+、Al3+、Cl-、NO
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO
+3Cl−+4H++H2O
B.NaHCO3溶液中加少量Ba(OH)2溶液:HCO
+Ba2++OH-=BaCO3↓+H2O
C.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
D.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:S2O
+2H+=SO2↑+S↓+H2O
难度: 中等查看答案及解析
-
下列有关化合物X、Y的说法不正确的是( )
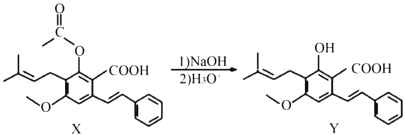
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙酸发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下,X、Y分别与足量Br2加成的产物分子中的手性碳原子数目相等
难度: 简单查看答案及解析
-
科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,W、Z核外电子数之和是X核外电子数的2倍,Y的最外层电子数是其质子数的
。下列叙述正确的是
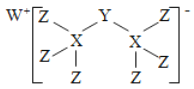
A. X、Z两元素可形成离子化合物
B. 气态氢化物的稳定性:X>Y>Z
C. 该新化合物中的Y元素满足8电子稳定结构
D. Y、Z元素分别对应的最高价氧化物的水化物均是强酸
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是 ( )
A.
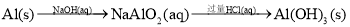
B.NaCl(aq)
Cl2(g)
FeCl2(s)
C.
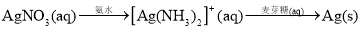
D.N2(g)
NH3(g)
Na2CO3(s)
难度: 简单查看答案及解析
-
测定0.1mol·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比试验,④产生白色沉淀多。下列说法错误的是( )
A. Na₂SO3溶液中存在水解平衡:SO32-+H2O
HSO-3+OH-
B. ④的pH与①不同,是由于SO32-浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
难度: 困难查看答案及解析
-
某试液中只可能含有K+、NH
、Fe2+、Al3+、Cl-、SO
、CO
、AlO
中的若干种离子,离子浓度均为0.1mol·L−1,某同学进行了如下实验,下列说法正确的是( )
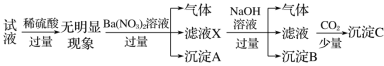
A.无法确定原试液中是否含有Al3+、Cl-
B.原溶液中存在NH
、Fe2+、Cl-、SO
C.无法确定沉淀C的成分
D.滤液X中大量存在的阳离子有NH
、Fe2+和Ba2+
难度: 中等查看答案及解析
-
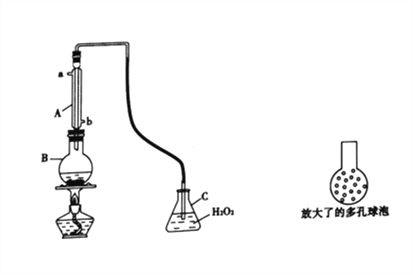
Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是
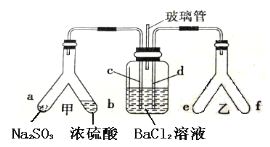
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D.Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
难度: 中等查看答案及解析
-
用二氧化碳可合成低密度聚乙烯(LDPE)。常温常压下以纳米二氧化钛膜为工作电极,电解CO2,可制得LDPE,该电极反应可能的机理如下图所示。下列说法正确的是
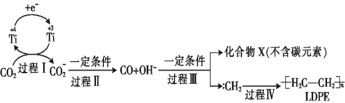
A. 含
的-极与电源负极相连
B. 过程Ⅰ、Ⅱ中碳元素均被还原,过程Ⅲ中碳元素被氧化
C. 电解过程中CO
向阴极迁移
D. 工业上生产1.4×104 g的LDPE,转移电子的物质的量为6×103 mol
难度: 简单查看答案及解析
-
25℃时,用浓度均为0.1 mol/L的NaOH溶液和盐酸分别滴定体积均为20mL、浓度均为0.1 mol/L的HA溶液与BOH溶液。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法中正确的是
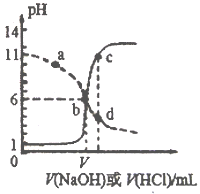
A. HA为弱酸,BOH为强碱
B. a点时,溶液中离子浓度存在关系: c(B+)>c(Cl-)>c(OH-)>(BOH)
C. b点时两种溶液中水的电离程度相同,且V=20
D. c、d两点溶液混合后微粒之间存在关系: c(H+)= c(OH-)+ c(BOH)
难度: 困难查看答案及解析
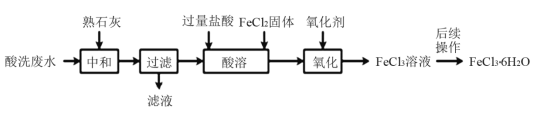
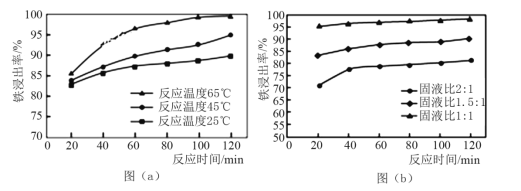
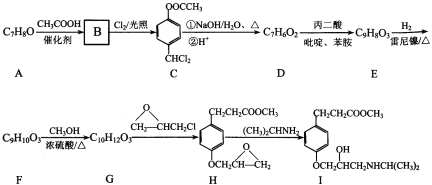
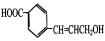 和
和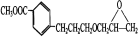 的合成路线______。
的合成路线______。