-
下列叙述错误的是( )
A. 13C和14C属于同种元素,它们互为同位素
B. 1H和2H是不同的核素,它们的质子数相等
C. 14C和14N的质量数相等,它们的中子数不等
D. 6Li和7Li的电子数相等,中子数也相等
难度: 简单查看答案及解析
-
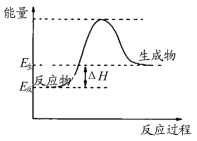
在298K、100kPa时,已知:
2H2O(g)=2H2(g)+O2(g) △H1
H2(g)+Cl2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是:
A.△H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1-2△H2 D.△H3=△H1-△H2
难度: 简单查看答案及解析
-
下列各组中每种物质都既有离子键又有共价键的一组是( )
A. NaOH H2SO4 (NH4)2SO4 B. MgO Na2SO4 HNO3
C. Na2O2 KOH Na3PO4 D. HCl Al2O3 MgCl2
难度: 简单查看答案及解析
-
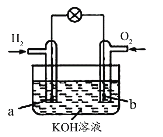
a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b 相连时,电流由a经导线流向b,c、d相连时,电子由d到c;a、c相连时,a极上产生大量气泡,b、d相连时,H+移向d极,则四种金属的活动性顺序由强到弱的顺序为
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列叙述错误的是( )
A.氢氧化铝是一种两性氢氧化物,可用于中和过多胃酸
B.海水提溴化工生产中,常用氧气作氧化剂
C.推广使用燃料电池汽车,可减少颗粒物、CO等有害物质的排放
D.电解精炼铜形成的阳极泥中含有银、金、铂等贵重金属
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.同周期元素中,ⅠA族元素的原子半径最小
B.仅由非金属元素不可能形成离子化合物
C.目前使用的元素周期表中,最长的周期含有32种元素
D.凡是有化学键断裂的过程一定发生了化学反应
难度: 简单查看答案及解析
-
利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧食盐样品时,钠的焰色为( )
A.黄色 B.红色 C.紫色 D.绿色
难度: 简单查看答案及解析
-
N2H4是一种高效清洁的火箭燃料。已知在25℃、101 kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
难度: 中等查看答案及解析
-
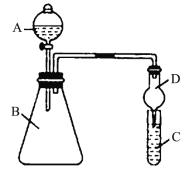
从海带中提取碘的实验中,包括灼烧、浸取和过滤、氧化、萃取、反萃取等步骤。下列说法正确的是( )
A.灼烧中用到的仪器有蒸发皿、三脚架、酒精灯、玻璃棒
B.过滤中用到的仪器只有烧杯、漏斗(带滤纸)、铁架台
C.萃取得到碘的四氯化碳溶液,分液时从分液漏斗上口倒出
D.反萃取是在碘的四氯化碳溶液中加入浓氢氧化钠溶液,振荡、静置、分液,再向水溶液中滴加45%硫酸溶液,过滤得固态碘
难度: 中等查看答案及解析
-
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )
A.原子半径:W>X>Z>Y
B.碱性:XOH>W(OH)2
C.离子半径:W2+>Y2-
D.热稳定性:H2Y>HZ
难度: 中等查看答案及解析
-
X、Y、Z、P、Q为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法正确的是
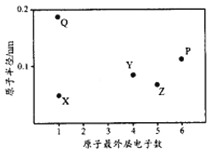
A.Q的氧化物一定含有离子键和共价键 B.最高价含氧酸的酸性:Z<Y
C.P的最低价氢化物常温常压下为液体 D.Y形成的化合物种类最多
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法错误的是( )
A.Z、Y、X的原子半径依次减小,非金属性依次降低
B.Z、Y、W的最高价氧化物的水化物的酸性依次降低
C.W与Y两种元素都存在多种同素异形体
D.Y的气态氢化物与Z的单质在一定条件下可发生氧化还原反应
难度: 中等查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。则下列说法正确的是( )

A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)反应吸收的能量为180kJ
D.1molN2(g)和1molO2(g)具有的总能量大于2molNO(g)具有的总能量
难度: 中等查看答案及解析