-
下列实验操作、现象及得出的结论均正确的是
选项
实验操作
实验现象
实验结论
A
Cu片与足量浓硫酸加热反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中
溶液变蓝
证明反应生成了Cu2+
B
向添加KIO3的食盐中加入淀粉溶液、稀硫酸、KI溶液
溶液变蓝
氧化性:IO3->I2
C
向20.00 mL浓度均为0.1 mol/L的Na2CO3和Na2S的混合溶液中滴加几滴等浓度的AgNO3溶液
只产生黑色沉Ksp(Ag2S)
Ksp(Ag2S)> Ksp(Ag2CO3)
D
室温下,用pH试纸分别测定浓度均为 0.1mol/L的Na2SO3和NaHSO3两种溶液的pH
pH:Na2SO3>NaHSO3
HSO3-结合H+能力比SO32-的强
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
[安徽省合肥市2019年高三第三次教学质量检测]化工生产与人类进步紧密相联。下列有关说法不正确的是
A.空气吹出法提取海水中溴通常使用SO2作还原剂
B.侯氏制碱法工艺流程中利用了物质溶解度的差异
C.合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D.工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2gD2O和H2l8O混合物中所含中子数为NA
B. 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
D. 0.1 mol H2和0.1 mol I2 (g)于密闭容器中充分反应,其原子总数为0.2NA
难度: 中等查看答案及解析
-
地奥司明片是治疗静脉淋巴功能不全相关的各种症状(腿部沉重、疼痛、晨起酸胀不适感)的主要治疗药物,下图为合成地奥司明片重要中间体,下列有关说法正确的是( )
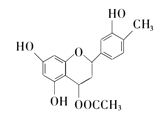
A. 分子式为C18H20O6
B. 该中间体是高分子化合物
C. 该中间体可发生水解反应生成乙醇
D. 该中间体分子在一定条件下可以发生取代、加成、氧化反应
难度: 中等查看答案及解析
-
短周期元素A、B、C、D、E的原子序数依次增大,A的原子得到一个电子达到稀有气体结构,B的单质通常作为瓜果、食品的保护气,E所在的族序数是周期数的2倍,C、D、E的最外层电子之和为10。下列说法正确的是( )
A.简单离子半径:E>B>C >D
B.C可以从溶液中置换出D单质
C.A、B、E形成化合物中只存在共价键
D.A和B形成的化合物溶于水可导电,所以该化合物为电解质
难度: 中等查看答案及解析
-
常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )
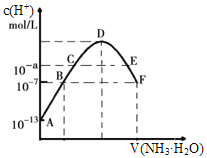
A.NaHB溶液可能为酸性,也可能为碱性
B.A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C.E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D.F点溶液c(NH4+)=2c(B2-)
难度: 困难查看答案及解析
-
以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )
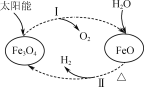
A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2O
Fe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
难度: 中等查看答案及解析
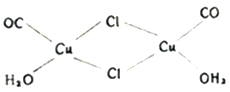
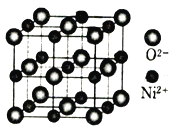


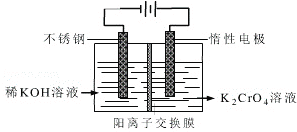
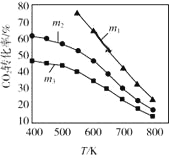
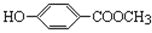 (尼泊金甲酯)
(尼泊金甲酯)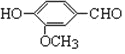 (香兰素)
(香兰素)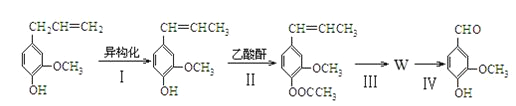
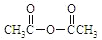 )
)