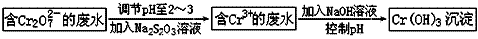-
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍。下列叙述错误的是
A.在反应Cr2O72—+I一+H+→Cr3++I2 +H2O中,氧化产物与还原产物的物质的量之比为3:2
B.一般情况下污水中的Cr3+在溶解的氧气的作用下易被氧化为Cr2O72—
C.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
D.维生素C具有还原性,发生铬中毒时,可服用维生素C缓解毒性
-
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康.不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性均为三价铬的100倍.下列叙述错误的是( )
A.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3:2
D.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72-
-
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性均为三价铬的100倍。下列叙述错误的是( )
A.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O72—+I一+H+→Cr3++I2 +H2O中,氧化产物与还原产物的物质的量之比为3:2
D.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72—
-
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。下列叙述错误的是
A.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3∶2
D.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72-
-
铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康。
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用的流程如下图所示:

Na2S2O3在此过程中表现________性。若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为_________价,反应的离子方程式为______________________。
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车。其反应原理如下,请配平该反应方程式:
(_____)CrO3 +(_____)CH3CH2OH +(_____)H2SO4 —(_____)CH3CHO + (_____)Cr2(SO4)3+(_____)H2O
(3)已知存在平衡:2CrO42-+2H+ Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
已知Ksp(BaCrO4)=1.25×10-10;Ksp(PbCrO4)=2.75×10-13;
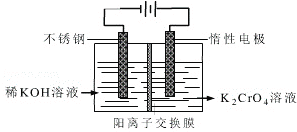
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图所示(阳离子交换膜只允许阳离子透过)。通电后阳极的电极反应式为____________________。请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因____________________。
-
铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康。
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72—,处理该废水常用的流程如下图所示:
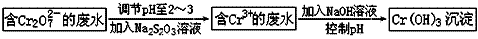
Na2S2O3在此过程中表现 性。若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为 价,反应的离子方程式为 。
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车。其反应原理如下,请配平该反应方程式:
( )CrO3 +( )CH3CH2OH +( )H2SO4 —( )CH3CHO + ( )Cr2(SO4)3+( )H2O
(3)已知存在平衡:2CrO42—+2H+  Cr2O72—+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+)/c(Ba2+)= 。
Cr2O72—+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+)/c(Ba2+)= 。
已知Ksp(BaCrO4)=1.25×10—10;Ksp(PbCrO4)=2.75×10—13

(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图所示(阳离子交换膜只允许阳离子透过)。通电后阳极的电极反应式为 。请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因 。
-
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排汇,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,六价格的毒性最大,几乎是三倍铬毒性的100倍。下列叙述错误的是
A.K2Cr2O7可以氧化乙醇,所以该反应常用于检查酒后驾驶
B.污水中的铬一般为三价铬,但在溶解氧的作用下可被氧化为六价铬
C.发生铬中毒时,可用维生素C缓解性,说明维生素C具有还原性
D.配平Cr2O72-+I-+H+→Cr3++I2+H2O后,Cr3+的化学计量数是4
-
铬是人体必需的微量元素,但铬过量会引起污染,危害人类健康.不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍.下列叙述错误的是
A.在反应Cr2O72﹣+I一+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3:2
B.一般情况下污水中的Cr3+在溶解的氧气的作用下易被氧化为Cr2O72﹣
C.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
D.维生素C具有还原性,发生铬中毒时,可服用维生素C缓解毒性
-
2012年4月15日,央视《每周质量报告》报道某著名制药企业使用工业明胶制造有毒胶囊,其中铬元素含量超标。铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍。下列叙述错误的是
A.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72—
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O72—+I一+H+→Cr3++I2 +H2O中,氧化产物与还原产物的物质的量之比为3:2
D.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性
-
2012年4月15日,央视《每周质量报告》报道某著名制药企业使用工业明胶制造有毒胶囊,其中铬元素含量超标。铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性为三价铬的100倍。下列叙述错误的是
A.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72—
B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶
C.在反应Cr2O72—+I一+H+→Cr3++I2 +H2O中,氧化产物与还原产物的物质的量之比为3:2
D.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性

Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。