-
化学与生活关系密切。下列关于生活中常见物质的说法,不正确的是( )
A.羊毛、蚕丝、塑料、合成橡胶都属于有机高分子材料
B.天然植物油没有恒定的熔沸点,常温下难溶于水
C.所有的油脂、糖类和蛋白质都能发生水解反应
D.麦芽糖及其水解产物均能发生银镜反应
难度: 中等查看答案及解析
-
下列物质互为同分异构体的是( )
A.淀粉和纤维素 B.乙醇和乙醚 C.乙酸乙酯和丁酸 D.石墨和C60
难度: 简单查看答案及解析
-
下列化学用语的表示,正确的是( )
A.乙炔的结构式: HC≡CH
B.苯的比例模型:
C.氯化铵的电子式:
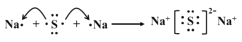
D.Na2S 的形成:
难度: 简单查看答案及解析
-
用
高能原子轰击
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A. 112号元素的相对原子质量为277
B. 此变化不属于化学变化
C. 科学家合成的112号元素是金属元素
D. 112号元素位于第七周期第ⅡB族
难度: 简单查看答案及解析
-
1869 年俄国科学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上重要的里程碑之一。下列有关元素周期表的说法,不正确的是( )
A.元素周期表有 7 个周期、16 个族,分别对应 7 个横行、16 个纵行
B.元素周期表指导科学家们在金属与非金属分界线附近寻找半导体材料
C.第 88 号元素位于元素周期表中第七周期第IIA 族
D.目前使用的元素周期表中,最长的周期有32 种元素
难度: 简单查看答案及解析
-
化学反应总伴随着多彩的颜色变化。下列对化学实验中颜色变化的叙述, 正确的是 ( )
A.木材纤维和土豆淀粉遇碘水均呈蓝色
B.淀粉溶液中加入适量稀硫酸并微热 4-5 分钟, 再加入少量新制 Cu(OH)2 悬浊液并加热,有砖红色沉淀生成
C.向鸡蛋清溶液中滴加几滴浓硝酸,微热,溶液变黄
D.将硬脂酸甘油酯滴入溴的四氯化碳溶液,溶液的红棕色褪去
难度: 中等查看答案及解析
-
为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
选项
A
B
C
D
被提纯物质
乙醇(水)
硝基苯(二氧化氮)
乙烷(乙烯)
溴苯(溴)
除杂试剂
生石灰
NaOH 溶液
酸性 KMnO4 溶液
KI 溶液
分离方法
过滤
分液
洗气
分液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
W、X、Y、Z 为原子序数依次增大的短周期元素, W 和 Y同族, X 和Z 同族, X 的简单离子和 Y 的简单离子具有相同的电子层结构, W 和 X、Z 能分别形成分子式为 XW3、 ZW3 的共价化合物,这两种共价化合物溶于水均呈碱性。下列说法不正确的是( )
A.四种元素中Y 的金属性最强
B.最高价氧化物对应水化物的酸性: Z > X
C.简单阳离子的氧化性: W>Y
D.化合物 YW 与水反应能生成还原性气体
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2 ) 是广泛用于橡胶工业的硫化剂, 其分子结构与 H2O2相似。常温下,S2Cl2 遇水易水解, 并产生使品红溶液褪色的无色气体。下列说法不正确的是( )
A.1 mol S2Cl2分子中含有 1 mol 非极性共价键和 2 mol 极性共价键
B.S2Cl2所有原子最外层都达到了 8 电子稳定结构
C.S2Br2 与S2Cl2 结构相似,沸点: S2Br2 < S2Cl2
D.S2Cl2 与 H2O反应的化学方程式可能为 2 S2Cl2+2H2O=SO2↑+ 3S↓+ 4HCl
难度: 中等查看答案及解析
-
下列对不同有机化合物的系统命名,正确的是 ( )
选项
A
B
C
D
物质
CH3CH2OOCCOOCH2CH3
系统命名
2- 甲基-2-丁烯
2-乙基丁烷
3-己酸
二乙酸二乙酯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
海洋是人类资源的宝库。下列关于实际工业中海洋资源的利用, 正确的是 ( )
A.制钠:从海水中提取精盐, 再电解纯净的 NaCl 水溶液
B.提镁:以海水为原料,经过一系列工艺制备氧化镁固体,用氢气高温下还原
C.提溴:向浓海水中通入足量氯气,然后直接蒸馏所得溴水
D.提碘:将海带灼烧、加水浸取、过滤得浸取液,再进行后续分离提纯操作
难度: 简单查看答案及解析
-
若NA 表示阿伏加德罗常数的值,则下列说法正确的是( )
A.1.24 g 白磷(P4)中含有 0.06NA 个非极性共价键
B.标准状况下 22.4 L CS2 中含有的共用电子对数目为 4NA
C.1 mol 乙酸乙酯在酸性条件下水解可生成NA个乙酸分子
D.电解 13.35 g 熔融态AlCl3,所得 Cl2 的分子数目为 0.15NA
难度: 中等查看答案及解析
-
实验室制备溴苯的实验装置如图所示。下列关于实验操作或结论的叙述,不正确的( )
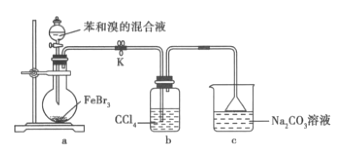
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b 中的液体逐渐变为橙红色
C.若欲验证该反应为取代反应,可将c 中碳酸钠溶液更换为硝酸银溶液
D.反应结束后将a 中混合液直接倒入NaOH 溶液中,充分反应后分液并进行后续分离提纯操作
难度: 简单查看答案及解析
-
如图展示了实验室制取少量乙酸乙酯的实验装置。下列关于该反应实验操作及现象的叙述,不正确的是( )
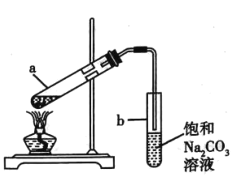
A.向a 试管中先加入乙醇,然后缓缓加入浓硫酸,边加边振荡试管,最后加入乙酸。
B.试管a 中通常加入过量的乙酸,目的在于提高乙醇的转化率
C.试管b 中导气管下端管口不能浸入液面以下,目的在于防止倒吸
D.反应结束后,若观察到试管b 中有少量白色固体析出,该固体可能为NaHCO3
难度: 中等查看答案及解析
-
如图为某“导电分子线”的结构,下列对该有机分子的说法,正确的是( )
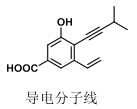
A.最多有 7 个原子共线
B.最多有 13 个碳原子共面
C.可发生加成、酯化、消去反应
D.不考虑立体异构,该分子中共有 7 种化学环境不同的氢
难度: 中等查看答案及解析
-
近年来分枝酸称为某些生化研究的热点,其结构如图所示。下列关于分枝酸的说法,正确的是( )

A.该化合物的分子式为C11H12O5,且含有两种官能团
B.能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色,且原理相同
C.1mol 分枝酸最多能与 3mol NaOH 发生中和反应
D.1mol 分枝酸与1mol Br2发生加成反应,可能得到4 种产物
难度: 中等查看答案及解析
-
Kevlar(凯夫拉),原名聚对苯二甲酰对苯二胺,具有超高的机械性能,是制作防弹衣的原材料。Kevlar 的结构片段如右图所示,则下列说法不正确的是( )

A.Kevlar 属于聚酰胺类合成高分子材料
B.图中虚线表示高分子链之间形成了类似肽链间的多重氢键,增强了材料的机械性能
C.Kevlar 可以发生完全水解,得到一种单体分子,该分子中既含有-COOH,又含有-NH2
D.Kevlar 高分子链的结构简式为

难度: 简单查看答案及解析
-
萜类化合物广泛存在于动植物体内。下列对以下A、B、C 三种萜类化合物的论述,正确的是( )
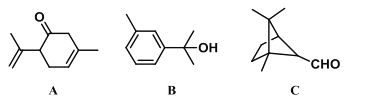
A.A、B、C 三种物质互为同分异构体
B.通过C-C 单键的旋转,物质B 可实现所有碳原子共平面
C.若不考虑立体异构,A和B 两种物质的等效氢种数不同
D.A、B、C 三种物质均可使酸性高锰酸钾溶液褪色
难度: 简单查看答案及解析
-
科学发展是旧理论不断被质疑、被打破的过程。苯曾被认为是“环己三烯”的结构,后经修正成为我们今天所学的理论。如图列举了几种常见的环状多烯结构,下列说法正确的是( )
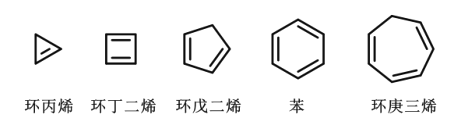
A.环丙烯、环丁二烯和环戊二烯均可分别实现所有碳原子共平面
B.上述五种化合物均可使溴的四氯化碳溶液褪色
C.上述五种化合物互为同系物,化学性质相似
D.依照上述环状多烯的结构规律,可以推测“环辛四烯”的分子式为C8H10
难度: 中等查看答案及解析
-
某芳香酯(分子式:C8H8O2)在酸性条件下水解,水解的产物重新组合成酯。若不考虑立体异构,则可重新形成的酯共有( )
A.10 种 B.12 种 C.15 种 D.18 种
难度: 简单查看答案及解析

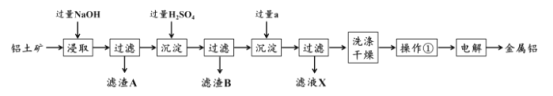
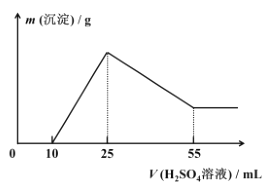
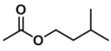 +H2O
+H2O