-
2020年5月1日北京市在全市范围内开展施行垃圾分类,下列垃圾分类不正确是( )
A.鱼骨、菜叶
B.消毒剂及其包装物
C.破损的易拉罐
D.破碎玻璃




厨余垃圾
有害垃圾
可回收垃圾
其他垃圾
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列对应化学用语的表示不正确的是
A.次氯酸的电子式:
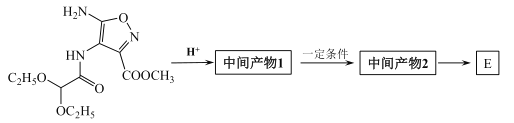
B.丁烷的球棍模型:
C.乙烯的结构简式:CH2=CH2 D.原子核内有 8 个中子的碳原子:
C
难度: 简单查看答案及解析
-
下列说法不正确的是
A.植物油氢化过程中发生了加成反应
B.苯和甲苯都能发生取代反应
C.氯乙烯和乙醛都能用来合成高分子化合物
D.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
难度: 中等查看答案及解析
-
设NA阿伏加德罗常数的值,下列说法不正确的是
A.10g的2H216O含有的质子数与中子数均为5NA
B.32g硫在足量的氧气中充分燃烧,转移电子数为6NA
C.26gC2H2与C6H6混合气体中含C—H键的数目为2NA
D.120gNaHSO4和KHSO3的固体混合物中含有的阳离子数为NA
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.向Ca(ClO)2溶液中通入过量CO2制次氯酸:2ClO− + H2O + CO2=2HClO +
B.[Ag(NH3)2]OH与较浓盐酸反应生成AgCl:[Ag(NH3)2]+ + OH− + 3H+ + Cl−=AgCl↓+2
+ H2O
C.Cl2与热的NaOH溶液反应制取NaClO3:2Cl2 + 6OH−
3Cl− +
+ 3H2O
D.向酸性KMnO4溶液中通入SO2:2
+ 5SO2 + 4OH−=2Mn2+ + 5
+ 2H2O
难度: 中等查看答案及解析
-
CO甲烷化反应为:CO(g)+3H2(g)=CH4(g)+H2O(l)。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢。

下列说法不正确的是( )
A.步骤①只有非极性键断裂
B.步骤②速率最慢的原因可能是其活化能最高
C.步骤③需要吸收热量
D.使用该催化剂不能有效提高CO的平衡转化率
难度: 中等查看答案及解析
-
完成下列实验,所选装置正确的是( )
A
B
C
D
实验
目的
实验室
制备乙烯
分离苯和溴苯的混合物(沸点:苯为80.1℃,溴苯为156.2℃)
分离KCl和NH4Cl固体混合物
实验室用纯碱和稀硫酸制备二氧化碳
实验
装置

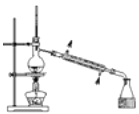


A.A B.B C.C D.D
难度: 简单查看答案及解析
-
聚氨酯类高分子材料PU用途广泛,其合成反应为n
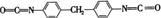 +(n+1)HO(CH2)4OH
+(n+1)HO(CH2)4OH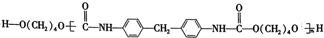 。下列说法错误的是( )
。下列说法错误的是( )A.
的沸点高于
B.高分子材料PU在强酸、强碱条件下能稳定存在
C.合成PU的两种单体的核磁共振氢谱中均有3组吸收峰
D.以1,
丁二烯为原料,可合成
难度: 中等查看答案及解析
-
三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正确的是
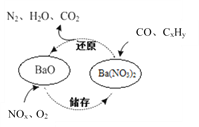
A. 在转化过程中,氮元素均被还原
B. 依据图示判断催化剂不参与储存和还原过程
C. 还原过程中生成0.1mol N2,转移电子数为0.5 mol
D. 三效催化剂能有效实现汽车尾气中CO、CxHy、NOx三种成分的净化
难度: 中等查看答案及解析
-
在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的关系如图所示(保持其他条件相同)。

在410~440℃温度范围内,下列说法不正确的是
A.当乙醇进料量一定,随乙醇转化率增大,乙烯选择性升高
B.当乙醇进料量一定,随温度的升高,乙烯选择性不一定增大
C.当温度一定,随乙醇进料量增大,乙醇转化率减小
D.当温度一定,随乙醇进料量增大,乙烯选择性增大
难度: 中等查看答案及解析
-
科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是( )
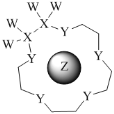
A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X
难度: 中等查看答案及解析
-
在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现,铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。

下列说法正确的是
A.铁片发生还原反应而被腐蚀
B.铁片腐蚀最严重区域应该是生锈最多的区域
C.铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-===4OH-
D.铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
难度: 中等查看答案及解析
-
25 ℃时,在含CH3COOH和CH3COO-的溶液中,CH3COOH、CH3COO-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法不正确的是( )

A.在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B.在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0
C.在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D.在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变
难度: 困难查看答案及解析
-
某学生探究0.25mol/L Al2( SO4)3溶液与0.5mol/L Na2CO3溶液的反应,实验如下:
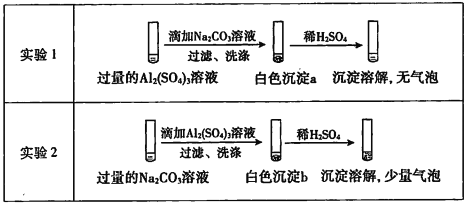
下列分析不正确的是
A. 实验I中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b含有CO32-
C. 实验l、2中,白色沉淀成分不同的原因与混合后溶液的pH无关
D. 检验白色沉淀a、b足否洗涤干净,均可用盐酸酸化的BaCl2溶液
难度: 中等查看答案及解析
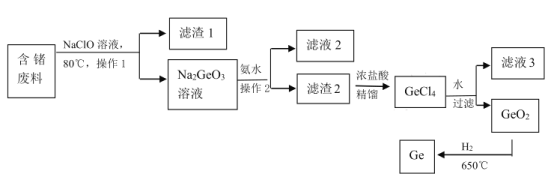

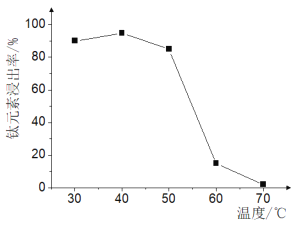


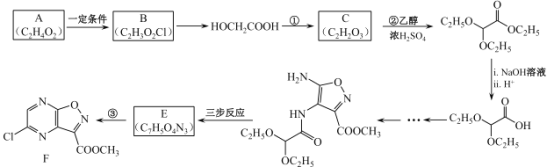
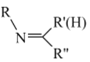 + H2O
+ H2O