-
下列操作过程中,利用物质的氧化性的是( )
A.明矾净化水 B.纯碱除去油污
C.臭氧用于餐具消毒 D.食醋清洗水垢
难度: 简单查看答案及解析
-
下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=FeSO4+Cu
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Fe2O3+3CO2
Fe+3CO2
D.2KMnO4
K2MnO4MnO2+O2↑
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是( )
A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数小于0.1NA
B.22.4L(标准状况)氩气含有的分子数为0.5NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.将1molFe与一定量的稀硝酸充分反应,转移的电子数可能为2NA
B.1mol苯甲酸中含有的双键数目为4NA
C.0.1mol/LNH4NO3溶液中含有的铵根离子数目为0.1NA
D.标准状况下,ll.2L苯中含有的原子数目为6NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2.0g D218O中所含中子数为NA
B.常温常压下,4.4g乙醛所含σ键数目为0.5NA
C.5.6L CO2与足量Na2O2反应转移的电子数为0.5NA
D.足量浓盐酸与0.1mol MnO2共热,充分反应,转移的电子数为0.2NA
难度: 中等查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
A.FeO B.Fe C.Cu D.Fe3O4
难度: 中等查看答案及解析
-
S2Cl2易与水反应:2S2Cl2+2H2O=4HCl+SO2↑+3S↓,下列说法正确的是( )
A.S2Cl2既作氧化剂又作还原剂
B.氧化产物与还原产物物质的量之比为3:1
C.每生成1mol SO2转移4mol电子
D.H2O作还原剂
难度: 简单查看答案及解析
-
下列关于反应:4Li+2SOCl2=4LiCl+S+SO2↑的叙述中,错误的是( )
A.SOCl2既是氧化剂又是还原剂,Li是还原剂
B.若1molSOCl2参加氧化还原,则转移的电子数为4NA(NA表示阿伏加德罗常数的值)
C.若将该反应设计成电池,则SOCl2在正极发生反应
D.若将该反应设计成电池,不能用水做为电解质溶剂
难度: 中等查看答案及解析
-
钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法正确的是( )
A.未知物质X为CO2,属于还原产物
B.每转移1mole-时,生成2molX
C.反应中PdCl2作还原剂,被氧化
D.还原性:CO>Pd
难度: 中等查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是( )
A.HF是还原产物
B.氧化产物与还原产物的物质的量之比是1:4
C.O2F2既是氧化剂又是还原剂
D.若生成标况下4.48LHF,则转移0.8mol电子
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向氯化钡溶液中通入少量SO2:Ba2++SO2+H2O=BaSO3↓+2H+
B.Fe(OH)3溶于HI:Fe(OH)3+3H+=Fe3++3H2O
C.大理石与醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.碳酸钠水【解析】
CO+H2O=HCO
+OH-
难度: 简单查看答案及解析
-
下列配制的溶液浓度偏高的是( )
A.用浓盐酸配制稀盐酸溶液时,用量筒量取盐酸后洗涤量筒
B.用浓盐酸配制稀盐酸溶液时,定容仰视容量瓶刻度线
C.配制0.1mol•L-1NaOH溶液1000mL时,使用的容量瓶未干燥
D.NaOH溶解后,注入容量瓶并定容至刻度线,上下颠倒摇匀后,发现液面低于刻度线,重新补加水至刻度线
难度: 简单查看答案及解析
-
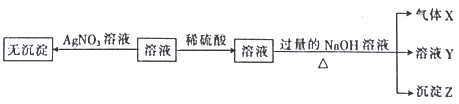
某铁的氧化物(FeOx)3.04g溶于足量盐酸中,向所得溶液中通入标准状况下224mLCl2,恰好完全氧化生成Fe3+。x值为( )
A.0.80 B.0.93 C.0.90 D.1.25
难度: 中等查看答案及解析
-
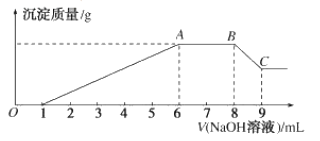
某溶液可能含有Cl-、SO
、CO
、NH
、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时观察到红褐色沉淀,过滤,洗涤,灼烧,得到1.6g固体:向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
A.CO
、Al3+一定不存在,K+可能存在
B.Cl-一定存在,且c(Cl-)=0.4mol/L
C.SO
、NH
一定存在,CO32-可能存在
D.原溶液中至少存在上述离子中的4种
难度: 困难查看答案及解析
-
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-
Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH-
Fe(OH)3↓+ BaSO4↓
D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+
B.加入NaHCO3溶液,产生白色沉淀,则原溶液-定有Al3+
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO
D.加入NaOH溶液,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定有NH
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是( )
①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+
②加入KSCN显红色的溶液:K+、NH
、Cl-、S2-
③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO
、K+
④pH=2的溶液中:NH
、Na+、Cl-、Cu2+
⑤由水电离出的c(OH-)=1×10-13mol•L-1的溶液中Mg2+、Ba2+、Cl-、Br-
A.②③ B.①③ C.①⑤ D.③④
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+l6N2↑。若氧化产物比还原产物多1.4mol,则下列判断正确的是( )
A.生成42.0LN2(标准状况)
B.有0.2molKNO3被氧化
C.转移电子的物质的量为1mol
D.被氧化的N原子的物质的量为1mol
难度: 困难查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol•L-1KI溶液:Na+、Ba2+、Fe3+、OH-
B.0.1mot•L-1Fe2(SO4)3溶液:Zn2+、NH
、Br-、SO
C.0.1mol•L1HNO3溶液:Ba2+、K+、ClO-、Cl-
D.0.1mol•L-1NaAlO2溶液:Mg2+、Na+、SO
、HCO
难度: 中等查看答案及解析
-
下列关于离子检验的说法中正确的是( )
A.向某溶液中加稀盐酸,将产生的无色无味气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定含有大量CO
B.向某溶液中加入盐酸酸化的硝酸钡溶液,有白色沉淀产生,则原溶液中一定有SO
C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液呈碱性
D.向某溶液中加入硝酸银溶液产生白色沉淀,再加稀硝酸,沉淀不消失,则原溶液中一定有Cl-
难度: 中等查看答案及解析
-
铁氧体(Fe3O4)法是处理含废铬水的常用方法,其原理是用FeSO4把废水中Cr2O
还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3•FeO)的复合氧化物(
)。CrxFe2-xO3•FeO处理含1molCr2O
废水至少需要加入amolFeSO4•7H2O。下列结论正确的是( )
A.x=0.5,a=10 B.x=1,a=5 C.x=2,a=l0 D.x=0.5,a=8
难度: 中等查看答案及解析
-
若一氧化氮和二氧化氮的混合气体的密度与同温同压下氧气的密度相同,混合气体中一氧化氮和二氧化氮的物质的量之比是( )
A.5:3 B.7:1 C.5:1 D.3:2
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得到的结论错误的是( )
选项
实验操作和现象
实验结论
A
向2mL0.1FeCl3的溶液中加足量铁粉,震荡,加1滴KSCN溶液,黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B
向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
部分Na2SO3被氧化
C
向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液加入淀粉后溶液变成蓝色
氧化性:Cl2>I2
D
向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色
溶液中含Br2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下表中离子方程式及其评价均合理的是( )
选项
化学反应及离子方程式
评价
A
氧化亚铁溶于稀硝酸FeO+2H+=Fe2++H2O
碱性氧化物与酸反应生成盐和水,正确
B
向亚硫酸铵溶液中加少量氢氧化钡溶液Ba2++SO
=BaSO3↓
复分解反应,有沉淀生成,正确
C
含nmolFeBr2的溶液中通入nmolCl2完全反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确
D
氯化铁溶液中滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3
复分解反应,无气体生成,无沉淀生成,不正确
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
选项
实验操作
现象
结论
A
向Na2SO4溶液中先加硝酸酸化,再加BaCl2溶液
无明显现象
不能用硝酸和BaCl2溶液检验SO
B
向AlCl3溶液中滴加过量氨水
溶液澄清
AlCl3与NH3·H2O能大量共存
C
将可调高度的铜丝伸入到稀HNO3中
溶液变蓝
Cu与稀HNO3发生置换反应
D
将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置
下层溶液显紫红色
氧化性:Fe3+>I2
A.A B.B C.C D.D
难度: 中等查看答案及解析