-
下列化学用语使用正确的是( )
A.次氯酸分子的结构式:H-Cl-O B.硫离子的结构示意图:
C.质量数为37的氯原子为:37Cl D.二氧化硅的分子式为:SiO2
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1molN2与4molH2充分反应生成的NH3分子数为2NA
B.1molNa218O2与足量CO2完全反应时生成碳酸钠的质量为106g
C.标准状况下,22.4LCHCl3含有的C—Cl键数为3NA
D.18g18O2中含有的中子数为10NA
难度: 中等查看答案及解析
-
糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述不正确的是
A.蛋白质最终能水解成氨基酸 B.淀粉是多糖,可在一定条件下水解
C.油脂属于酯类化合物 D.葡萄糖不具有还原性
难度: 简单查看答案及解析
-
下列排列顺序正确的是
①热稳定性:H2O>HF>H2S②原子半径:Na>Mg>O③酸性:H3PO4>H2SO4>HClO4④得电子能力:C<N<O<F⑤沸点:H2S>H2O>HF
A.②④ B.①③④ C.①④⑤ D.②⑤
难度: 简单查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大。其中W的阴离子的核外电子数与其他三种元素原子的内层电子数相同。X、Y均能与Z分别形成原子个数比为1∶1、1∶2的气态化合物。根据以上叙述,下列说法不正确的是
A.化合物W4Y2Z3可以为离子化合物
B.X、Y、Z都可与W形成既有极性共价键又有非极性共价键的化合物
C.W、X形成的化合物分子中所有原子最外层电子数均为8
D.沸点:W2Z>YW3>XW4
难度: 中等查看答案及解析
-
某有机物其结构简式如图,关于该有机物,下列叙述不正确的是
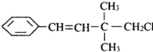
A.一定条件下,能发生加聚反应
B.1mol该有机物能与H2发生反应,消耗H2物质的量为4mol
C.该有机物有三种官能团
D.该有机物苯环上的一个H被取代,有3种同分异构体
难度: 中等查看答案及解析
-
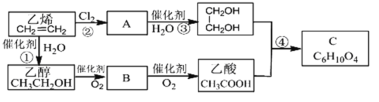
催化氧化产物是
的醇是
A.
 B.
B.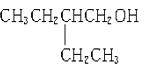
C.
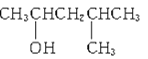 D.
D.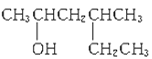
难度: 中等查看答案及解析
-
20mL某气态烃完全燃烧消耗O2(相同条件下)130mL,则该烃在光照条件下与Cl2发生取代反应生成的一氯代物共有
A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图所示,下列说法中正确的是
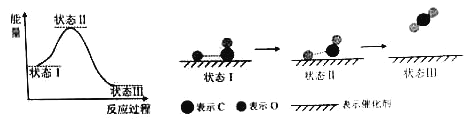
A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O
C.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 D.CO和O生成了具有极性共价键的CO2
难度: 简单查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
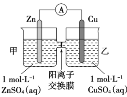
A.铜电极上发生氧化反应
B.电池工作一段时间后,乙池溶液的总质量增加
C.电池工作一段时间后,甲池的c(
)减小
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 中等查看答案及解析
-
一定温度下,20mL0.40mol/LH2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如表.
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈1.67×10-2mol/(L•min)
B.6~10min的平均反应速率:v(H2O2)<1.67×10-2mol/(L•min)
C.反应至6min时,c(H2O2)=0.30mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析
-
有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16。三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,以下说法不正确的是
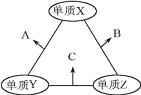
A.A和C不可能发生氧化还原反应
B.X元素位于ⅥA族
C.A不能溶解于B中
D.B的沸点高于C的沸点
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.光照条件下,氯气与乙烷发生化学反应,生成的产物有6种
B.甲烷中的乙烯可用酸性高锰酸钾溶液来除去
C.只用水就可以鉴别四氯化碳、苯和乙醇
D.制取一氯乙烷的最佳途径是通过乙烷与氯气反应获得
难度: 中等查看答案及解析
-
下列物质在给定条件下的同分异构体数目正确的是
A.C4H10属于烷烃的同分异构体有3种
B.分子组成是C5H10O2属于羧酸的同分异构体有5种
C.分子组成是C5H10O属于醛的同分异构体有3种
D.
的一溴代物有5种
难度: 中等查看答案及解析
-
甲基丙烯酸甲酯是合成有机玻璃的单体。旧|法合成的反应是:
①(CH3)2C=O+HCN→(CH3)2C(OH)CN
②(CH3)2C(OH)CN+CH3OH+H2SO4→CH2=C(CH3)COOCH3+NH4HSO4
新法合成的反应是:③CH3C≡CH+CO+CH3OH
CH2=C(CH3)COOCH3
下列说法不正确的是
A.甲基丙烯酸甲酯有两种官能团 B.反应③符合绿色化学思想
C.反应②中CH3OH是CH2OHCH2OH(乙二醇)的同系物 D.反应①是加成反应
难度: 简单查看答案及解析
-
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
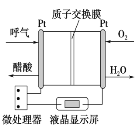
A.H+从左侧经过质子交换膜移向右侧
B.该电池的负极反应式为CH3CH2OH+3H2O-12e-===2CO2↑+12H+
C.电流由O2所在的铂电极流出
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
难度: 简单查看答案及解析