-
某学生在实验室制取乙酸乙酯的主要步骤如下:①在大试管A中配制反应混合液;②按图甲所示连接装置(装置气密性良好),用小火均匀加热大试管5~10min;③待试管B收集到一定量产物后停止加热,撤去导管并用力振荡,然后静置待分层;④分离出乙酸乙酯层,洗涤、干燥。
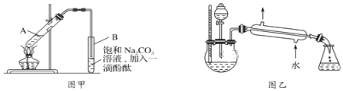
已知乙醇可以与氯化钙反应,生成微溶于水的CaCl2•6C2H5OH;无水硫酸钠易吸水形成硫酸钠结晶水合物。
(1)上述实验中饱和Na2CO3溶液的作用是_________。
(2)步骤②中需要小火均匀加热,其主要原因之一是温度过高会发生副反应,另一个原因是_________。
(3)写出步骤③中观察到的实验现象_________。
(4)分离出乙酸乙酯层后,一般用饱和CaCl2溶液洗涤,通过洗涤可除去的杂质是_________(填名称)。
(5)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产品产率为_________。(保留一位小数)
(6)某化学课外小组设计了图乙所示的装置制取乙酸乙酯(图中铁架台、铁夹、加热装置均已略去),与图甲装置相比,图乙装置的主要优点有_________(填字母)。
a.增加了温度计,有利于控制反应温度b.增加了分液漏斗,能随时补充反应混合液
c.增加了冷凝装置,利于收集产物d.反应容器容积大,容纳反应物的量多,反应速率快
-
已知下列数据:
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;
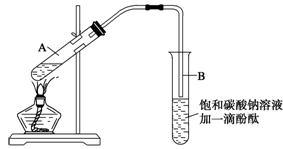
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为________ _______________。
_______________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)__________ __________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是________________________。
(4)分离出乙酸乙酯 后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)______。
后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)______。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(5)浓硫酸的作用是:① ;② 。
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(8)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是 ,该过程中发生反应的化学方程式是 。
-
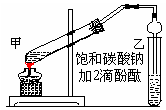
(6分)实验室制取乙酸乙酯的主要步骤如下:
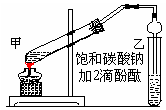
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)配制该混合溶液的主要操作步骤为:_______________________________________ ;反应中浓硫酸的作用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇。
B.中和乙酸并吸收部分乙醇。
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器________(填:“下口放” 或“上口倒”)出。
-
(10分)实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇。
B.中和乙酸并吸收部分乙醇。
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。
D.加速酯的生成,提高其产率。
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器________(填:“下口放” 或“上口倒”)出。
-
(12分)实验室制取乙酸乙酯的主要步骤如下:
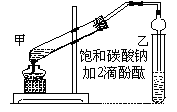
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________
(2)甲试管中混合溶液的加入顺序:___________________________________;
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
A.中和乙酸和乙醇。
B.中和乙酸并吸收部分乙醇。
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。
D.加速酯的生成,提高其产率。
(4)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器________ (填:“下口放” 或“上口倒”)出。
(5)生成乙酸乙酯的反应是可逆反应,反应一段时间后,就达到了该反应的限度.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) __________
①混合物中各物质的浓度不再变化;②单位时间里,生成1mol乙醇,同时生成1mol乙酸;③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸.
-
某学习小组在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液。
②按如图连接好装置并加入混合液,用小火均匀加热3~5min。
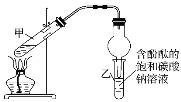
③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
回答问题:
(1)配制混合液的操作顺序是___。
(2)装置中球形干燥管,除起冷凝作用外,另一重要作用是___。
(3)步骤②安装好实验装置,加入药品前还应检查___。
(4)写出实验中加热试管的目的:①___;②___。
(5)反应中浓硫酸的作用是__;写出能表示18O位置的制取乙酸乙酯的化学方程式:___。
(6)上述实验中饱和碳酸钠溶液的作用是__。(填字母)
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(7)步骤③所观察到的现象是___,从试管乙中分离出乙酸乙酯的实验操作名称是___。
-
某学习小组在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液
②按如图连接好装置并加入混合液,用小火均匀加热3~5min
③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层
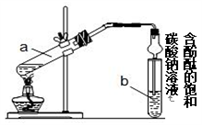 ④分离出乙酸乙酯,洗涤、干燥。
④分离出乙酸乙酯,洗涤、干燥。
回答问题:
(1)装置中球形干燥管,除起冷凝作用外,另一重要作用是____________________。
(2)步骤(2)安装好实验装置,加入样品前还应检查____________________。
(3)反应中浓硫酸的作用是______________________;
写出能表示18O位置的制取乙酸乙酯的化学方程式________________________。
(4)上述实验中饱和碳酸钠溶液的作用是(填字母)_____________。
A.中和乙酸并吸收乙醇 B.中和乙酸和乙醇
C.加速酯的生成,提高其产率 D.减少乙酸乙酯的溶解
(5)从试管乙中分离出乙酸乙酯的实验操作名称是 __________________。
-
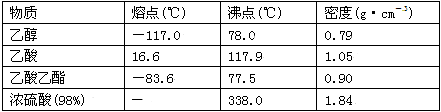
实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
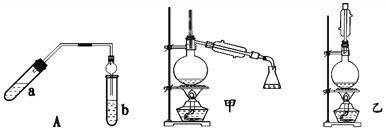
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:_________。
(2)分离出乙酸乙酯层后,经过洗涤杂质;为了干燥乙酸乙酯可选用的干燥剂为______。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
(3)为充分利用反应物,该同学又设计了图中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为更合理的是_________________。理由是:________________________________________________。
-
乙酸乙酯可以做白酒勾兑用香料、人造香精。实验室制乙酸乙酯的主要装置如图7所示,主要步骤:①在a试管中按3∶2∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按图7连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液中;③小火加热a试管中的混合液;④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出乙酸乙酯。(加热装置略)
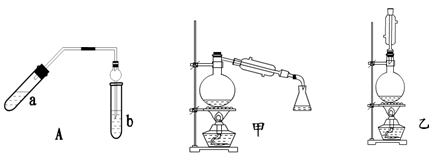
图7 图8 图9
请回答下列问题:
(1)步骤①中,配制混合溶液的正确操作是 。
(2)步骤②中b试管中饱和Na2CO3溶液的主要作用 。(填字母)
a. 降低乙酸乙酯的溶解度
b. 除去实验中挥发出来的硫酸
c. 除去乙酸乙酯中混有的乙酸和乙醇
(3)图7装置中使用球形干燥管除起到冷凝作用外,另一重要作用是 ,步骤⑤中分离乙酸乙酯必须使用的一种玻璃仪器是 。
(4)为充分利用反应物,提高乙酸乙酯产量,甲、乙两位同学分别设计了图8和图9两种装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为效果较好的是 。
(5)若实验中用CH3CH218OH的乙醇与乙酸(CH3COOH)作用,此反应的化学方程式为 。
-
实验室制乙酸乙酯得主要装置如图中A所示,主要步骤:
①在a试管中按2∶3∶2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。
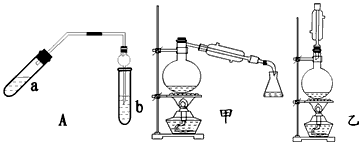
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:________
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是_____________________;步骤⑤中分离乙酸乙酯必须使用的一种仪器是_______________________________。







 ④分离出乙酸乙酯,洗涤、干燥。
④分离出乙酸乙酯,洗涤、干燥。

