-
化学与生活密切相关。下列叙述错误的是
A.不锈钢是一种主要含Fe、Cr、Ni且不易生锈的合金钢
B.陶瓷属于无机非金属材料,陶瓷中不含金属元素
C.煤层气中含有甲烷,可用作清洁燃料和化工原料
D.适量SO2可用于对食物杀菌防腐、抗氧化
难度: 简单查看答案及解析
-
设阿伏加德罗常数的值为NA。有关化工原料苯乙炔
的下列叙述正确的是
A.51 g该物质中含有单键数目为2NA B.标准状况下,22.4 L苯乙炔最多消耗2NA个HCl
C.1mol苯乙炔分子中共线的原子数最多为6NA D.苯乙炔与足量H2加成产物的一氯代物有5种
难度: 中等查看答案及解析
-
某小组探究实验条件对反应速率的影响,设计如下实验,并记录结果如下:
编号
温度
H2SO4溶液
KI溶液
1%淀粉溶液体积
出现蓝色时间
①
20℃
0.10 mol·L-110 mL
0.40 mol·L-1 5 mL
1mL
40 s
②
20℃
0.10 mol·L-110 mL
0.80 mol·L-1 5 mL
1mL
21 s
③
50℃
0.10 mol·L-110 mL
0.40 mol·L-1 5 mL
1mL
5s
④
80℃
0.10 mol·L-110 mL
0.40 mol·L-1 5 mL
1mL
未见蓝色
下列说法正确的是
A.由实验①②可知,反应速率v与c(I-)成正比
B.实验①-④中,应将H2SO4溶液与淀粉溶液先混合
C.在I-被O2氧化过程中,H+只是降低活化能
D.由实验③④可知,温度越高,反应速率越慢
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D的原子序数依次增大,A、C同主族,C、D相邻;+1价B+离子核外电子排布与稀有气体Ne的相同;A、B、C的原子序数之和为35,且可形成正盐X(化学式B2C2A3),X与稀H2SO4反应产生气体与黄色沉淀。下列说法一定正确的是
A.简单离子半径:B> D B.简单气态氢化物的热稳定性:A <C
C.X只具有还原性 D.B2A2是一种含非极性键的离子化合物
难度: 简单查看答案及解析
-
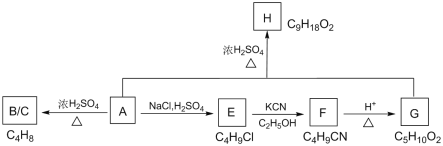
最近,中国科学家在《焦耳》杂志在线发表的一篇论文中首提“液态阳光”,即“太阳燃烧”,属于可再生绿色液态燃料。某模拟“人工树叶”的“液态阳光”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料异丙醇(CH3)2CHOH。下列说法正确的是
A.该装置将化学能转化为光能和电能
B.a电极反应为3CO2+ 16H+- 18e-= (CH3)2CHOH + 4H2O
C.该装置工作时,H+从b极区向a极区迁移
D.异丙醇可发生氧化反应、还原反应、取代反应和聚合反应
难度: 困难查看答案及解析
-
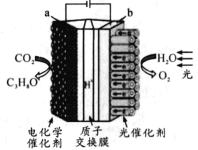
25℃时,浓度均为0.100 mol/L的HA溶液和BOH溶液各20.00 mL,分别用0.100 mol/L NaOH溶液、0.100 mol/L 盐酸进行滴定,滴定过程中pH随滴加溶液体积变化关系如图,两图像关于pH=7呈上下对称。下列说法错误的是
A.曲线Ⅰ表示盐酸滴加到BOH溶液的过程,可用甲基橙作指示剂
B.Ka(HA) =Kb(BOH),交点对应横坐标V< 20.00 mL
C.曲线Ⅰ,滴加溶液到10.00 mL时:c(BOH) > c(Cl-) > c(OH-) >c(H+)
D.曲线Ⅱ,滴加溶液到5.00~10.00 mL时:c(A-) +c(OH-) =c(H+) +c(Na+)
难度: 中等查看答案及解析
-
CuSO4溶液是实验室中常用试剂。下列与CuSO4溶液有关实验的操作和结论都一定正确的是
选项
A
B
C
D
实验操作
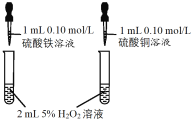
前者产生气泡更快
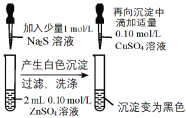
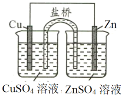
Cu片上发生还原反应
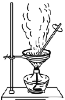
蒸发CuSO4溶液
结论
Fe3+催化效果好于Cu2+
Ksp(CuS) < Ksp(ZnS)
Cu片为正极反应物
可获得胆矾晶体
A.A B.B C.C D.D
难度: 中等查看答案及解析