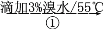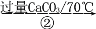-
葡萄糖酸锌[Zn(C6H11O7)2]是一种有机补锌剂,广泛应用于食药领域。已知葡萄糖酸锌能溶于水,易溶于热水,不溶于乙醇。某小组由葡萄糖制备葡萄糖酸锌的实验步骤如下:
I.制备葡萄糖酸(C6H12O7):
60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温15 min。
II.制备葡萄糖酸钙[Ca(C6H11O7)2]:
将略过量CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生。过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用。
III.制备葡萄糖酸锌粗品(装置如右,夹持、控温装置略):
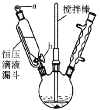
在90℃水浴、搅拌下,向ZnSO4溶液中分批加入葡萄糖酸钙溶液。趁热过滤,向滤液中加入无水乙醇并冷却析晶,过滤。
请回答下列问题:
(1) 步骤I中溴水的作用是作______,判断溴水略过量的现象是______。
(2) 步骤II中用CaCl2代替CaCO3可行吗?______ (填“可行”或“不可行”),乙醇可洗去葡萄糖酸钙固体表面杂质,还具有______、______优点。
(3) 步骤III中,恒压滴液漏斗需要打开活塞______ (填“a”、“b”或“a和b”),90℃下,葡萄糖酸钙与硫酸锌发生反应的离子方程式为______。
(4) 葡萄糖酸锌粗品含少量难溶于水的杂质,纯化晶体的合理操作顺序是______ (选填写正确序号)。
① 蒸发浓缩至溶液表面出现晶膜;② 待晶体充分析出后,减压过滤;③ 将滤液冷却至室温,加入10 mL 95%乙醇溶液并搅拌,促进晶体析出;④ 趁热减压过滤,除去不溶物;⑤ 在50℃下用恒温干燥箱烘干,称重;⑥ 取烧杯加入10 mL蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液。
(5) 测定产品纯度步骤如下:
取mg提纯后的产品溶于水配成100mL溶液,取25.00mL置于____中,加入V1mLc1 mol·L-1Na2EDTA溶液(过量)和指示剂,用c2 mol·L-1 Zn2+标准溶液滴定至终点,发生反应:Zn2++EDTA2—=Zn-EDTA,三次滴定平均消耗锌标准溶液V2mL,则该产品的纯度为______%(保留1个数字系数)。
-
葡萄糖酸锌{M[Zn(C6H11O7)2]=455g·mol-1)是一种重要的补锌试剂,其在医药、食品、饲料、化妆品等领城中具有广泛的应用。纯净的葡葡糖酸锌为白色晶体,可溶于水,极易溶于热水,不溶于乙醇,化学兴趣小组欲在实验室制备葡萄糖酸锌并测定产率。实验操作分以下两步:
Ⅰ.葡萄糖酸(C6H12O7)的制备。量取50 mL蒸馏水于100 mL烧杯中,搅拌下缓慢加入2.7 mL(0.05 mol)浓H2SO4,分批加入21.5 g葡萄糖酸钙{M[Ca(C6H11O7)2]=430g·mol-1,易溶于热水},在90℃条件下,不断搅拌,反应40min后,趁热过滤。滤液转移至小烧杯,冷却后,缓慢通过强酸性阳离子交换树脂,交换液收集在烧杯中,得到无色的葡葡糖酸溶液。
Ⅱ.葡萄糖酸锌的制备。向上述制得的葡萄糖酸溶液中分批加入足量的ZnO,在60℃条件下,不断搅拌,反应1h,此时溶液pH≈6。趁热减压过滤,冷却结晶,同时加入10 mL 95%乙醇,经过一系列操作,得到白色晶体,经干燥后称量晶体的质量为18.2g。
回答下列问题:
(1)制备葡萄糖酸的化学方程式为________________。
(2)通过强酸性阳离子交换树脂的目的是_______________。
(3)检验葡萄糖酸溶液中是否存在SO42-的操作为_________。
(4)制备葡萄糖酸时选用的最佳加热方式为_______________。
(5)制备葡萄糖酸锌时加入乙醇的目的是________,“一系列操作”具体是指_______。
(6)葡萄糖酸锌的产率为______(用百分数表示),若pH≈5时就进行后续操作,产率将_____(填“增大”“减小”或“不变”)。
-
用如图装置制备FeCO3,提取出的FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。已知:葡萄糖酸亚铁(C6H11O7)2Fe是常用的补铁剂,易溶于水。回答下列问题:
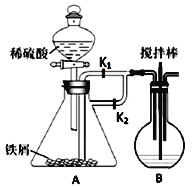
Ⅰ(1)B中加入药品Na2CO3,要使A中制得的FeSO4溶液进入B中发生反应,实验开始时,应打开分液漏斗的活塞、______,关闭______,一段时间后,关闭_______,打开________ (填旋塞的编号)。
(2)将葡萄糖酸与碳酸亚铁混合,反应的化学方程式为(有机物用分子式表示)________________。
(3)从环境保护的角度分析,该装置存在不足之处是:_____________。
Ⅱ.某补铁剂的主要成分是硫酸亚铁,用氧化还原滴定法可测定该补铁剂中铁元素的含量,实验的主要步骤如下:
①取10片补铁剂样品,溶解除去不溶物(不损耗铁元素),并配成100mL待测溶液。
②量取25.00mL待测液于锥形瓶中。
③用c mol·L−1的酸性KMnO4溶液滴定至终点,记录消耗KMnO4溶液的体积,重复两次实验,平均消耗KMnO4溶液体积为V mL。
(4)该滴定原理的离子方程式为______________________
(5)上述实验中应该用稀硫酸酸化KMnO4溶液,如果用硝酸对KMnO4溶液进行酸化,对测定结果的影响是________(填“偏大”“偏小”或“无影响”)。滴定终点的实验现象为______。
(6)每片补铁剂含铁元素的质量为__________g(用代数式表示)。
-
葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。葡萄糖酸亚铁的制备方法之一是由新制备的碳酸亚铁(白色固体,微溶于水)与葡萄糖酸反应而制得,其流程如下:
(1)用下图装置制备FeCO3
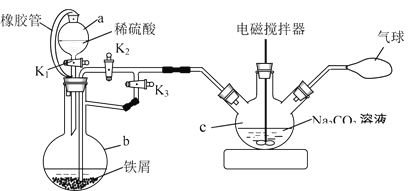
①仪器b的名称为_________。仪器a中橡胶管的作用是_______。
②反应开始时,先打开活塞K1和K3,关闭K2,目的是_______。一段时间后,关闭_______,打开______,目的是_______。
③将制得的FeCO3过滤、洗涤。检验沉淀已经洗涤干净的试剂为______(若多种试剂,按试剂使用由先到后的顺序填写)。
④用NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,反应的离子方程式为________。
(2)反应II中加入过量葡萄糖酸使溶液显弱酸性,原因是________。
(3)葡萄糖酸亚铁结晶时需加入乙醇,目的是____________。
-
葡萄糖酸亚铁[(C6H11O7)2Fe]是医疗上常用的补铁剂,易溶于水,几乎不溶于乙醇。某实验小组同学拟用下图装置先制备FeCO3,再用FeCO3与葡萄糖酸反应进一步制得葡萄糖酸亚铁。

请回答下列问题:
(1)与普通漏斗比较,a漏斗的优点是___。
(2)按如图连接好装置,检査气密性后加入药品,打开K1和K3,关闭K2。
①b中的实验现象___。
②一段时间后,关闭___,打开___(选填“K1”“K2”或“K3”),观察到b中的溶液会流入c中,同时c中析出FeCO3沉淀。
③b中产生的气体的作用是___。
(3)将c中制得的碳酸亚铁在空气中过滤时间较长时,表面会变为红褐色,用化学方程式说明其原因:___。
(4)将葡萄糖酸与碳酸亚铁混合,须将溶液的pH调节至5.8,其原因是___。向上述溶液中加入乙醇即可析出产品,加入乙醇的目的是___。
(5)有同学提出用NaHCO3溶液代替Na2CO3溶液制得的碳酸亚铁纯度更高,其可能的原因是___。
-
葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:
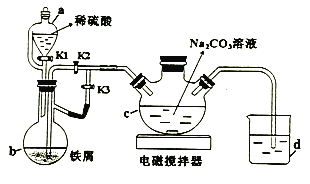
(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在_________(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有_________、____________。(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
-
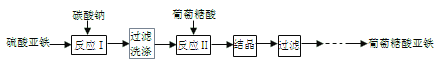
葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:
C6H12O6溶液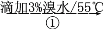

 悬浊液
悬浊液

 Ca(C6H11O7)2
Ca(C6H11O7)2
请回答下列问题:
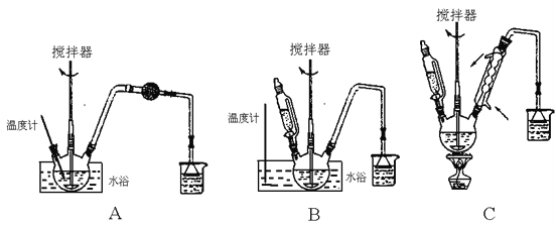
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是________。
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是______。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是______________________;本实验中不宜用CaCl2替代CaCO3,理由是_________________________________。
(3)第③步需趁热过滤,其原因是______________________________________。
(4)第④步加入乙醇的作用是_________________________________________。
(5)第⑥步中,下列洗涤剂最合适的是________________________________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
-
葡萄糖酸亚铁[(C6H11O7)2Fe•2H2O]是重要的矿物质添加剂,它的吸收效果比无机铁盐好。一种工业上制备葡萄糖酸亚铁的工艺流程如下:
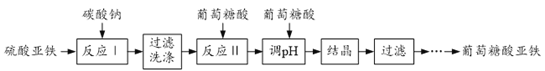
(1)反应Ⅰ的化学方程式为______。
(2)①碳酸亚铁过滤时需在表面保留水层的原因是______;
②检验FeCO3已经洗涤干净的操作为______。
(3)反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是______。
(4)葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的分别是______,______。
-
葡萄糖酸亚铁[(C6H11O7)2Fe•2H2O]是重要的矿物质添加剂,它的吸收效果比无机铁盐好。一种工业上制备葡萄糖酸亚铁的工艺流程如下:

(1)反应Ⅰ的化学方程式为______。
(2)①碳酸亚铁过滤时需在表面保留水层的原因是______;
②检验FeCO3已经洗涤干净的操作为______。
(3)反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是______。
(4)葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的分别是______,______。
-
“稳定性二氧化氯溶液”是淡黄色透明液体,广泛应用于食品卫生等领域的杀菌消毒。ClO2沸点11℃,是一种黄绿色的气体,易溶于水。ClO2稳定性较差,“稳定性二氧化氯溶液”是以碳酸钠为稳定剂,有效成分为NaClO2。
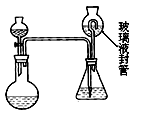
某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(用样品和酸反应产生二氧化氯的质量与样品质量的比值来衡量)。请回答下列问题:
(1)为证实“稳定性二氧化氯溶液”中含有钠离子,其正确的操作步骤是:________。
(2)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取mg(2g左右)试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液;②在锥形瓶中加入4g碘化钾,用100mL水溶解后,再加3mL硫酸溶液;③在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至蓝色消失(I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。
(Ⅰ)NaClO2与盐酸反应生成ClO2(还原产物为Cl-),该反应的化学方程式为:
;ClO2通入锥形瓶与酸性碘化钾溶液反应,二氧化氯被还原为氯离子,该反应的离子方程式为: 。
(Ⅱ)装置中玻璃液封管的作用是:;如何确定烧瓶中的二氧化氯全部被锥形瓶中的液体吸收。
(Ⅲ)“稳定性二氧化氯溶液”中,ClO2的质量分数为 (用m、c、V表示)。