-
在2mL NaCl溶液中加入1滴AgNO3溶液,有白色沉淀生成;再加入1滴KI溶液,沉淀转化为黄色,然后再加入1滴Na2S溶液,沉淀又转化为黑色(以上所用的溶液物质的量浓度均相同),下列表示各沉淀物溶解度由大到小的顺序正确的是
A. Ag2S 、 AgI 、 AgCl B. AgCl 、 AgI 、 Ag2S
C. AgI 、 AgCl、 Ag2S D. AgCl 、 Ag2S 、 AgI
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.吸热反应在一定条件下也能发生
B.放热的反应在常温下一定很易发生
C.反应是吸热还是放热必须看反应物和生成物具有的总质量的相对大小
D.需加热方能发生的反应一定是吸热反应
难度: 简单查看答案及解析
-
下列操作中,能使电离平衡 H2O
H++OH-,向右移动且溶液呈酸性的是( )
A.向水中加入NaHSO3溶液 B.向水中加入 NH4Cl 溶液
C.向水中加入CH3COONa 溶液 D.将水加热到 100℃,使 pH=6
难度: 简单查看答案及解析
-
已知常温下0.1mol/L CH3COOH溶液中c(H+)=1.32×10-3mol/L,则该CH3COOH溶液中的水的离子积常数Kw是
A.1×10-14 B.1×10-13 C.1.32×10-14 D.1.32×10-15
难度: 中等查看答案及解析
-
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
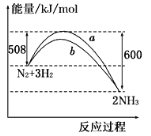
A.该反应的热化学方程式为:N2+3H2
2NH3 △H=-92 kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不改变
D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92kJ
难度: 中等查看答案及解析
-
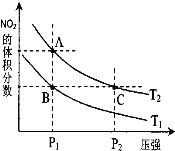
下列变化不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.H2、I2(g)混合气体加压后颜色变深
C.红棕色的NO2加压后颜色先变深再变浅
D.实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Al3+、Cl-、SO
B.室温下,pH=1的盐酸中:Na+、Fe2+、NO
、SO
C.含有Ca2+的溶液中:Na+、K+、CO
、Cl-
D.水电离产生的c(H+)=1x10-13 mol/L的溶液中:Na+、K+、Cl-、SO
难度: 简单查看答案及解析
-
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A.C(s) +O2(g) = CO2(g) ΔH=+110.5 kJ·mol−1
B.CH4(g) +2O2(g) = CO2(g)+2H2O(l) ΔH=-890.31 kJ·mol−1
C.H2(g) +
O2(g)= H2O(g) ΔH=-241.8 kJ·mol−1
D.2C8H18(l) +25O2(g) = 16CO2(g)+18H2O(l) ΔH=-11036 kJ·mol−1
难度: 简单查看答案及解析
-
用NaOH标准溶液滴定未知浓度的盐酸,用酚酞为指示剂,造成测定结果偏高的原因可能是
A.配制标准溶液的NaOH中混有Na2CO3杂质
B.盛装待测液的锥形瓶用燕馏水洗过,没有用待测液洗
C.滴定到终点读数时,俯视刻度线
D.滴定到终点读数时,滴定管尖嘴处有气泡
难度: 中等查看答案及解析
-
室温下的四种溶液:①pH=9的 NaOH 溶液 ②pH=9的CH3COONa溶液 ③pH=5的H2SO4溶液 ④pH=5的NaHSO4 溶液,溶液中由水电离产生的c(OH-)相同的是( )
A.①② B.①③ C.③④ D.①③④
难度: 中等查看答案及解析
-
对于反应2NO2(g)
N2O4(g),在一定条件下达到平衡,在温度不变时,欲使
的比值增大,应采取的措施是( )
①体积不变,增加NO2的物质的量;②体积不变,增加N2O4的物质的量;③使体积增大到原来的2倍;④充入N2,保持压强不变
A.①② B.②③ C.①④ D.③④
难度: 中等查看答案及解析
-
下列有关电解质溶液中粒子浓度关系正确的是( )
A.将 HCl 与 CH3COONa 两溶液混合后,溶液呈中性,则 c(Na+) < c(Cl-)
B.向 NH4Cl 溶液中通 NH3,则 c(
) >c(Cl-) > c(OH-)> c(H+)
C.室温下,c(
)相同的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 溶液浓度大小顺序为:①>②>③
D.已知 pKa= -lgKa,pKa(HF)=3.1,pKa(C6H5COOH) = 4.2,室温下,等体积、等浓度的 NaF、C6H5COONa 溶液中,前者离子总数小于后者
难度: 中等查看答案及解析
-
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析
-
有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol·L-1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
难度: 中等查看答案及解析
-
某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)
cC(g)表示]的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
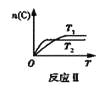
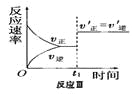
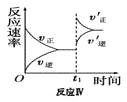
A.反应I:若p1>p2,则此反应只能在高温下自发进行
B.反应Ⅱ:此反应的△H<0,且T1<T2
C.反应Ⅲ:表示t1时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
难度: 困难查看答案及解析
-
根据表中数据判断,下列选项结论正确的是( )
酸
H2C2O4
HCN
H2CO3
电离常数(25℃)
K1=5.4×10-2
K2=5.4×10-5
4.9×10-10
K1=4.4×10-7
K2=4.7×10-11
A.NaCN+H2O+CO2(少量) = HCN+NaHCO3
B.0.1 mol∙L-1的Na2CO3溶液逐渐滴加到同浓度的 HCN 溶液中,无现象,说明未发生反应
C.浓度均为 0.1 mol∙L-1的Na2CO3、NaHCO3、NaCN、NaHC2O4溶液,pH 最大的是NaCN
D.NaHC2O4溶液中,离子浓度由大到小的顺序是c(Na+)>c(H+)>c(HC2O
) >c(C2O
) >c(OH-)
难度: 中等查看答案及解析