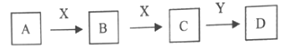-
在酸性条件下,可发生如下反应:ClO3-+2M3++4H2O=M2O7n-+Cl-+8H+,M2O7n- 中M的化合价是
A.+4 B.+5 C.+6 D.+7
难度: 简单查看答案及解析
-
某无色酸性溶液中,则该溶液中一定能够大量共存的离子组是( )
A.Fe2+、Ba2+、NO3-、Cl- B.Na+、NH4+、SO42-、Cl-
C.Na+、K+、SO32-、NO3- D.Na+、K+、MnO4-、Br-
难度: 中等查看答案及解析
-
化学与生产生活密切相关,下列有关说法错误的是( )
A.改变能源结构,开发利用清洁能源,可防治酸雨
B.生石灰可用作食品包装中的干燥剂,禁止入口
C.为增强杀菌消毒效果,可将“84消毒液”和“洁厕灵”混合使用
D.维生素C具有还原性,食用维生素C含量较高的食物有利于人体对铁元素的吸收
难度: 中等查看答案及解析
-
分类是学习和研究化学的重要方法,下列物质的分类合理的是( )
A.苛性钠、熟石灰、纯碱均属于碱
B.CO2、SO2、SO3均属于酸性氧化物
C.次氯酸、氢硫酸、磷酸均属于含氧酸
D.NH4Cl、NH4NO3、CO(NH2)2均属于铵盐
难度: 简单查看答案及解析
-
下列有关胶体叙述正确的是( )
A.常用于区分溶液和胶体的方法是丁达尔效应,属化学方法
B.许多胶体能进行电泳是因为这些胶体带电
C.胶体不均一,不稳定
D.向Fe(OH)3胶体中滴加稀硫酸的现象是:先形成红褐色沉淀后溶解
难度: 简单查看答案及解析
-
下列实验中没有用到玻璃棒的是( )
A.配制100mL0.2mol•L-1NaOH溶液
B.食盐的精制
C.浓硫酸的稀释
D.Fe(OH)3胶体的制备
难度: 简单查看答案及解析
-
下列转化不能通过一步反应实现的是( )
A.NH3→NO2 B.H2S→S C.FeCl2→ZnCl2 D.NaHCO3→Na2CO3
难度: 中等查看答案及解析
-
科学规范保存试剂以防变质,下列试剂在实验室中的保存方法错误的是( )
A.少量金属钠保存在盛有煤油的广口瓶中
B.浓硫酸盛放在使用橡胶塞密封的广口瓶中
C.浓硝酸密封盛放在棕色细口玻璃瓶中,置于阴凉处
D.保存FeSO4溶液加入少量铁粉并密封
难度: 简单查看答案及解析
-
下列物质性质与用途对应关系错误的是( )
选项
化学性质
用途
A
HClO具有强氧化性
用于自来水杀菌消毒
B
铁具有还原性
用作食品抗氧化剂
C
Na2CO3可与酸反应生成CO2气体
用作焙制糕点的膨松剂
D
Na2O2可与CO2、H2O反应产生O2
用作潜艇中的供氧剂
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列结论正确的是( )
A. 加入有色布条,片刻后有色布条褪色,说明有Cl2存在
B. 溶液呈浅黄绿色,且有刺激性气味,说明有Cl2存在
C. 先加入盐酸酸化,再加入AgNO3溶液,生成白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水的浅黄绿色消失,说明有HClO存在
难度: 中等查看答案及解析
-
根据SO2通入不同溶液中的实验现象,所得结论错误的是( )
选项
溶液
现象
结论
A
H2O2溶液
无明显现象
SO2与H2O2不反应
B
H2S溶液
产生淡黄色沉淀
SO2有氧化性
C
酸性KMO4溶液溶液
紫色褪去
SO2有还原性
D
滴有酚酞的NaOH溶液
溶液红色褪去
SO2有酸性氧化物的性质
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
能正确表示下列化学反应的离子方程式的是( )
A.用稀硫酸吸收氨气:NH3+H+=NH4+
B.碳酸镁与稀硫酸反应:CO32-+2H+=H2O+CO2↑
C.铜溶于氯化铁溶液中:Fe3++Cu=Fe2++Cu2+
D.氧化亚铁投于稀硝酸中:FeO+2H+=Fe2++H2O
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22.4LSO2中含有分子数为NA
B.28gN2和CO的混合物中,所含分子总数一定为NA
C.0.1mol•L-1NaCl溶液中含有的Na+离子数为0.1NA
D.同温同压下,相同体积的氢气和氖气所含原子数均为2NA
难度: 简单查看答案及解析
-
实验室需要90mL1.0mol•L-1的NaOH溶液,下列有关配制该溶液的说法正确的是( )
A.需要称量3.6gNaOH固体
B.该实验用到的玻璃仪器只有烧杯、玻璃棒和容量瓶
C.定容时俯视刻度线会使所配溶液的浓度偏高
D.摇匀后发现容量瓶中液体低于刻度线,再用胶头滴管滴加水至刻度线
难度: 中等查看答案及解析
-
下列反应物按所给物质的量配比进行反应,其中固体完全反应的是( )
A.n(Cu):n(HNO3浓)=1:4 B.n(Fe):n(HNO3浓)=1:2
C.n(C):n(H2SO4浓)=1:2 D.n(MnO2):n(HCl浓)=1:4
难度: 简单查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是( )
选项
操作和现象
结论
A
向某溶液中加入少量新制氯水后再加几滴KSCN溶液,溶液变为红色
该溶液中一定含有Fe2+
B
向某溶液加入稀硝酸和Ba(NO3)2溶液,无明显现象,再加入AgNO3溶液,产生白色沉淀
该溶液中一定没有SO42-,一定含有Cl-
C
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体
该溶液中一定含有CO32-或HCO3-
D
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解
该溶液中一定含有SO42-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
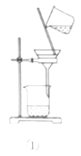
利用如图所示装置进行实验,不能达到相应实验目的的是( )
A.利用装置①分离Fe(OH)3胶体和FeCl3溶液
B.利用装置②干燥、收集氨气并吸收多余的氨气

C.利用装置③收集NO2气体
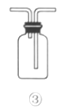
D.利用装置④证明Cl2易与NaOH溶液反应
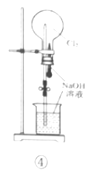
难度: 中等查看答案及解析
-
一定条件下,NH3和CuO可发生反应:2NH3+3CuO=3Cu+N2+3H2O,对此反应的分析合理的是( )
A.该反应是置换反应
B.NH3被还原为N2
C.反应中氧化剂和氧化产物的物质的量之比为3:1
D.若反应中生成1moH2O,则转移电子的物质的量为lmol
难度: 中等查看答案及解析
-
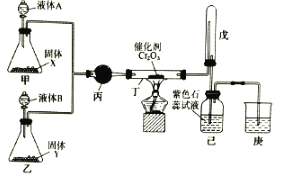
为防治含硫煤燃烧产生的大气污染,某工厂设计了新的治污方法,工艺流程如图所示。下列叙述错误的是( )
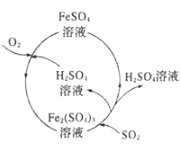
A.该流程可以除去煤燃烧时产生尾气中的SO2,变废为宝
B.该流程中H2SO4和Fe2(SO4)3溶液可以循环利用
C.流程中每吸收11.2LSO2(标准状况)同时产生1molFe2+
D.流程中涉及的Fe2+被氧化的反应的离子方程式为4Fe2++O2+2H2O═4Fe3++4OH-
难度: 中等查看答案及解析
-
将质量为mg的铜屑完全溶于适量浓硝酸中,反应后得到NO2、NO的混合气体,将所得气体通入300mL2mol•L-1NaOH溶液中,恰好完全反应,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为0.2mol,则m的值为( )
A.12.8 B.19.2 C.25.6 D.51.2
难度: 中等查看答案及解析