-
今有下列三个氧化还原反应:(1)2FeCl3+2KI =2FeCl2+2KCl+I2(2)2FeCl2+Cl2 = 2FeCl3 (3)2KMnO4+16HCl = 2KCl+2MnCl2+8H2O+5Cl2↑ 若某溶液中有 Fe2+ 和 I- 共存,要氧化除去I-而又不影响Fe2+ 和Cl- ,可加入的试剂是
A. FeCl3 B. KMnO4 C. Cl2 D. HCl
难度: 中等查看答案及解析
-
下列物质中,不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.金箔
难度: 简单查看答案及解析
-
下列物质属于电解质的是( )
A.Ba(OH)2 B.Cu C.Cl2 D.酒精
难度: 中等查看答案及解析
-
下列有关离子方程式错误的是( )
A.盐酸与氢氧化钡溶液反应:H++OH-=H2O
B.碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.铜粉与足量的稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.硫酸铝溶液与过量氢氧化钠溶液反应:Al3++3OH-=Al(OH)3↓
难度: 中等查看答案及解析
-
某溶液中含有Na+、K+、HCO3-、SO32-等离子。向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是( )
A.Na+ B.SO32- C.K+ D.HCO3-
难度: 中等查看答案及解析
-
下列物质都具有漂白性,漂白原理与其它几种不同的是( )
A.氯水 B.SO2 C.H2O2 D.HClO
难度: 中等查看答案及解析
-
只用一种试剂区别Na2SO4、MgCl2、Al2(SO4)3三种溶液,这种试剂是( )
A.H2SO4 B.Ba(OH)2 C.NaOH D.AgNO3
难度: 中等查看答案及解析
-
ClO2是一种新型水消毒剂,工业上用NaClO2与盐酸反应制备ClO2的反应为5NaClO2+4HCl(稀)=5NaCl+4ClO2↑+2H2O,下列说法正确的是( )
A.反应中HCl作还原剂
B.ClO2之所以能做水消毒剂,是利用了它的强氧化性
C.反应中氧化产物与还原产物物质的量之比为4:5
D.反应中每生成1molClO2转移4mol电子
难度: 中等查看答案及解析
-
一块表面己被缓慢氧化的金属钠,其质量为10.8g,投入100g水中,收集到氢气0.2g。则原来钠块表面被氧化的钠的质量是
A.6.2g B.4.6g C.7.8g D.10.6g
难度: 困难查看答案及解析
-
下列叙述中,错误的是( )
A.摩尔是物质的量的单位
B.36g水中含氢原子数目为4NA(NA表示阿伏加德罗常数的值)
C.在0.5molNa2SO4中,含有的Na+数约是6.02×1023
D.等质量的O2与O3,所含氧原子数之比为3:2
难度: 中等查看答案及解析
-
节日燃放的烟花利用了“焰色反应”的原理。下列说法中正确的是
A.焰色反应属于化学变化
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.某样品的焰色颜色为黄色,则该样品仅含有钠元素
D.焰色反应时金属丝应用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取样品灼烧
难度: 简单查看答案及解析
-
高纯度晶体硅是良好的半导体材料,它的发现和使用引起了计算机的一场“革命”。它可以按下列方法制备:
SiO2
Si(粗)
SiHCl3
Si(纯)
下列说法不正确的是( )
A.步骤③中氢气作还原剂
B.硅和二氧化硅都能用作计算机“芯片”
C.步骤①的化学方程式为:SiO2+2C
Si+2CO↑
D.步骤①②③中发生的反应都属于氧化还原反应
难度: 中等查看答案及解析
-
下列实验能达到目的的是( )
A
B
C
D
实验室制备Fe(OH)2
实验室制氯气
分离胶体和溶液
油、水分离
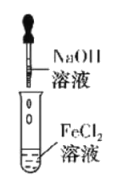
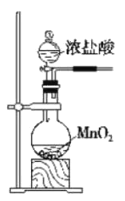
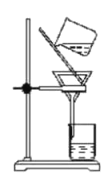
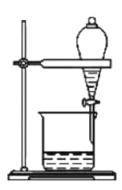
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
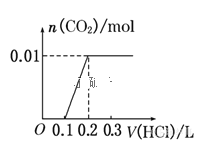 B.
B.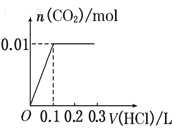
C.
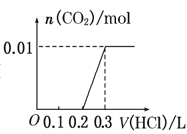 D.
D.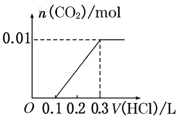
难度: 困难查看答案及解析
-
充满NO2和O2混合气体30mL的试管倒立于水中,最终试管中剩余5mL气体,则原试管中NO2和O2的体积比可能是
A.1︰1 B.3︰1 C.5︰1 D.9︰1
难度: 中等查看答案及解析