-
下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是




A.4.03米大口径碳化硅反射镜
B.2022年冬奥会聚氨酯速滑服
C.能屏蔽电磁波的碳包覆银纳米线
D.“玉兔二号”钛合金筛网轮
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是
A.12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B.5.8g熟石膏(2CaSO4 • H2O)含有的结晶水分子数为0.02NA
C.4.6g C2H6O中含C-H键数为0.6NA
D.1L甲醛气体完全燃烧消耗O2的数目约为
难度: 中等查看答案及解析
-
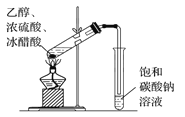
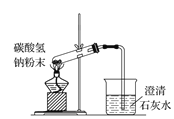
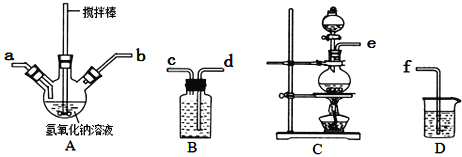
下列图示实验正确的是( )
A.制取蒸馏水
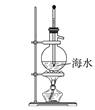
B.制取收集氨气

C.乙酸乙酯的制备
D.碳酸氢钠受热分解
难度: 中等查看答案及解析
-
β一l,3一葡聚糖具有明显的抗肿瘤功效,受到日益广泛的关注。β-l,3一葡聚糖的结构简式如图,下列说法正确的是
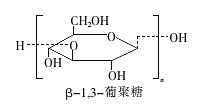
A.分子式为(C6Hl2O6)n B.与葡萄糖互为同系物
C.可以发生氧化反应 D.葡萄糖发生加聚反应可生成β-l,3一葡聚糖
难度: 中等查看答案及解析
-
化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
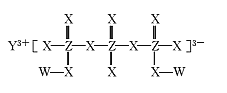
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
难度: 中等查看答案及解析
-
中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:
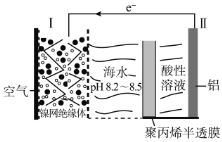
下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为:O2+4H++4e-=2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极II为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4g时,正极消耗3.36L气体
难度: 简单查看答案及解析
-
甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
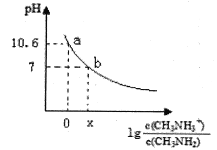
A.b点对应加入盐酸的体积V<20.00mL
B.常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C.b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D.V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
难度: 中等查看答案及解析
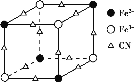
 ,该配离子中含有的化学键类型有___(填字母)。
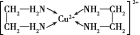
,该配离子中含有的化学键类型有___(填字母)。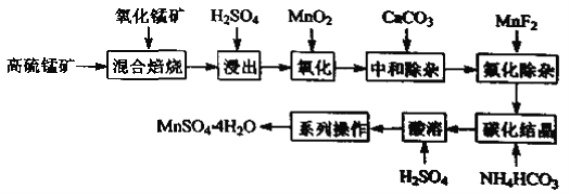
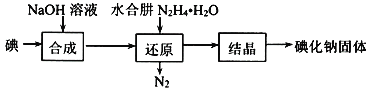
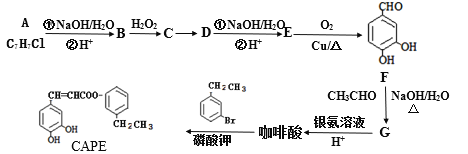
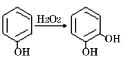 ;
;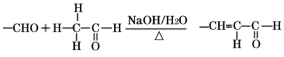 。
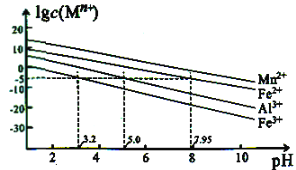
。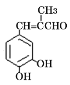 的合成路线____。
的合成路线____。