-
研究发现,反应CCl4(g)+H2(g) CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g) CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2 CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | α1 |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验(其他条件相同)。测得CCl4的消耗百分率(x%,实线)和生成物中CHCl3的百分含量(y%,虚线)随时间(t)的变化关系如图。
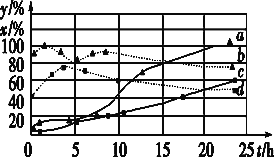
①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
-
研究发现,反应CCl4(g)+H2(g) CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g) CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2 CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | α1 |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验(其他条件相同)。测得CCl4的消耗百分率(x%,实线)和生成物中CHCl3的百分含量(y%,虚线)随时间(t)的变化关系如图。

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
-
研究发现,反应CCl4(g)+H2(g) CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g) CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2 CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | α1 |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验(其他条件相同)。测得CCl4的消耗百分率(x%,实线)和生成物中CHCl3的百分含量(y%,虚线)随时间(t)的变化关系如图。
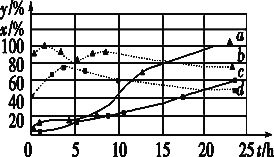
①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
-
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2⇌CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L﹣1) | 初始H2浓度(mol•L﹣1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后反应达到平衡,则从反应开始至达到平衡状态,H2的平均反应速率为 mol•L﹣1•h﹣1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动? (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为 (填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为 .
(4)在100℃条件下,能说明反应CCl4+H2⇌CHCl3+HCl△H<O达到平衡状态的是 (填字母).
A.压强不再变化
B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变
D.H2的质量不再变化
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理简单,设备占地面积小,废水中的重金属离子也能通过电解有所降低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,其装置示意图如图所示.

①若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入 ,a极的电极反应为 .
②能否用铜作电解重铬酸钠废水的电极? (填“能”或“不能”),理由是
③除去重铬酸根离子的离子反应是 .
-
下列关系正确的是( )
A.沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B.密度:CCl4>CHCl3>H2O>苯
C.含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D.同物质的量的物质燃烧耗O2量:己烷>环己烷>苯>苯甲酸
-
溴乙烷是一种重要的液体化工原料,沸点38.4℃,难溶于水且非电解质,可与碱溶液反应。实验室中可利用如下原理制取少量溴乙烷:
NaBr+H2SO4(浓)+ C2H5OH→NaHSO4+C2H5Br
某研究性学习小组的同学设计了如图所示的装置(支持及加热仪器已省略)来制备溴乙烷,并验证有副产物SO2、CO2生成(SO2沸点为-10℃)
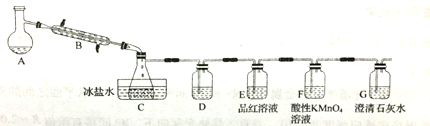
(1)仪器B的名称是_____,装置D用来检验并除去乙烯,则D中的化学方程式为:__________。F的作用是__________。证明一定有CO2生成的现象是_________。
(2)C中所得到的溴乙烷中含有少量的乙醇、Br2、HBr。为得到纯净的溴乙烷,该同学取出C中的液体依次用水洗 _________洗
_________洗 水洗,再用无水CaCl2干燥,最后进行蒸馏。洗涤实验中,所用的玻璃仪器除烧杯外还一定需要的仪器名称是_____________。
水洗,再用无水CaCl2干燥,最后进行蒸馏。洗涤实验中,所用的玻璃仪器除烧杯外还一定需要的仪器名称是_____________。
(3)假设上述实验都得到了预期的实验现象,写出乙醇与浓硫酸反应生成上述无机气体时的化学方程式:______________。
(4)设计一种实验方案,利用化学方法证明C中的液体中含有单质溴:____________。
-
为保护环境,科学家致力二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质,如将CO2与H2混合,在一定条件下以1:3的比例发生反应,生成某种重要的化工原料和水,该化工原料可能是
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
-
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2 CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
| 实验序号 | 温度℃ | 初始CCl4浓度(mol·L﹣1) | 初始H2浓度(mol·L﹣1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后反应达到平衡,则从反应开始至达到平衡状态,H2的平均反应速率为 mol·L﹣1·h﹣1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动? (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为 (填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为 .
(4)在100℃条件下,能说明反应CCl4+H2 CHCl3+HCl△H<O达到平衡状态的是 (填字母).
CHCl3+HCl△H<O达到平衡状态的是 (填字母).
A.压强不再变化 B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变 D.H2的质量不再变化
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理简单,设备占地面积小,废水中的重金属离子也能通过电解有所降低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,其装置示意图如图所示.
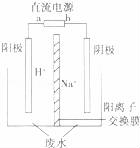
若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入 ,a极的电极反应为 .
能否用铜作电解重铬酸钠废水的电极? (填“能”或“不能”),理由是
③除去重铬酸根离子的离子反应是 .
-
乙二醇(沸点:197.3℃)是一种重要的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应I:4NO(g)+4CH3OH(g)+O2(g) 4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
反应II:2CO(g)+2CH3ONO(g) CH3OOCCOOCH3(l) + 2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2=b kJ·mol-1
反应III:CH3OOCCOOCH3(1)+4H2(g) HOCH2CH2OH(1)+2CH3OH(g) △H3 =c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3 =c kJ·mol-1
请回答下列问题:
(1)煤基合成气间接合成乙二醇的总热化学方程式是_____________________________,已知该反应在较低温条件下能自发进行。说明该反应的△H ______0(填“>”“<”或“=”)。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2 L的密闭容器中发生反应II,达到平衡时CO的体积分数与NO的体积分数相等,计算该反应的化学平衡常数K=_____________。若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时NO 的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂的活性参数——空时收率和CO的选择性可表示如下:
空 时收率=CH3OOCCOOCH3质量/反应时间×催化剂的体积
CO的选择性=合成[CH3OOCCOOCH3所消耗的CO的物质的量/反应掉的CO 的物质的量]×100%
在不同温度下,某学习小组对四组其他条件都相同的反应物进行研究,经过相同时间th,测得空时收率、CO的选择性数据如下表所示。
| 反应温度(℃) | 空时收率(g·mL-1·h-1) | CO的选择性(%) |
| 130 | 0.70 | ①72.5 |
| 140 | 0.75 | ②71.0 |
| 150 | 0.71 | ③55.6 |
| 160 | 0.66 | ④63.3 |
下列说法正确的是________(填字母代号)。
A.温度升高,空时收率先增大后减小,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO 的选择性逐渐降低
C.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
D.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
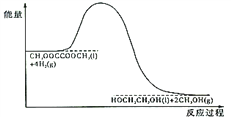
(4)120℃、常压时,CH3OOCCOOCH3 +4H2 HOCH2CH2OH+2CH3OH 反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
HOCH2CH2OH+2CH3OH 反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是________________。
-
乙二醇(沸点:197.3℃)是一种重要的的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应 I:4NO(g)+ 4CH3OH (g)+ O2 (g) 4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1
4CH3ONO(g)+ 2H2O(g) △H1=a kJ·mol-1
反应 II:2CO(g)+2CH3ONO(g) CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=bkJ·mol-1
反应III:CH3OOCCOOCH3 (1)+ 4H2(g) HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1
HOCH2CH2OH(1)+ 2CH3OH (g) △H3=ckJ·mol-1
(1)煤基合成气间接合成乙二醇的总热化学方程式是_________,在较低温条件下,该反应能自发进行的可能原因是_________。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应II,达到平衡时NO的体积分数33.3%,若此时向容器中通入0.4molNO,一段时间后,重新达到新平衡时NO的体积分数_________33.3% (填“>”、“=”、“<”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂活性参数:空时收率和CO选择性,表示式如下:
空时收率=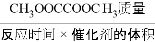
CO的选择性=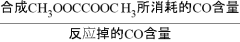 ×100%
×100%
在不同温度下,某兴趣小组对四组其他条件都相同的反应物进行研究,经过相同时间t小时,测得空时收率、CO选择性数据如下表所示。
| 反应温度(℃) | 空时收率(g· mL-1· h-1) | CO的选择性(% ) |
| 130 | 0.70 | ① 72.5 |
| 140 | 0.75 | ② 71.0 |
| 150 | 0.71 | ③ 55.6 |
| 160 | 0.66 | ④ 63.3 |
下列说法正确的是_________。
A.温度升高,空时收率先增大后减少,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO的选择性逐渐降低,所以数据④肯定错误
C.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
D.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
(4)120℃、常压时,CH3OOCCOOCH3+4H2 HOCH2CH2OH +2CH3OH 反应过程中能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中能量变化图。_______
HOCH2CH2OH +2CH3OH 反应过程中能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中能量变化图。_______

(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是_________。
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。







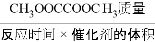
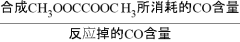 ×100%
×100%