-
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2 CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
| 实验序号 | 温度℃ | 初始CCl4浓度(mol·L﹣1) | 初始H2浓度(mol·L﹣1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后反应达到平衡,则从反应开始至达到平衡状态,H2的平均反应速率为 mol·L﹣1·h﹣1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动? (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为 (填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为 .
(4)在100℃条件下,能说明反应CCl4+H2 CHCl3+HCl△H<O达到平衡状态的是 (填字母).
CHCl3+HCl△H<O达到平衡状态的是 (填字母).
A.压强不再变化 B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变 D.H2的质量不再变化
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理简单,设备占地面积小,废水中的重金属离子也能通过电解有所降低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,其装置示意图如图所示.
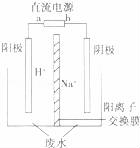
若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入 ,a极的电极反应为 .
能否用铜作电解重铬酸钠废水的电极? (填“能”或“不能”),理由是
③除去重铬酸根离子的离子反应是 .
-
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2⇌CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L﹣1) | 初始H2浓度(mol•L﹣1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后反应达到平衡,则从反应开始至达到平衡状态,H2的平均反应速率为 mol•L﹣1•h﹣1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动? (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为 (填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为 .
(4)在100℃条件下,能说明反应CCl4+H2⇌CHCl3+HCl△H<O达到平衡状态的是 (填字母).
A.压强不再变化
B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变
D.H2的质量不再变化
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理简单,设备占地面积小,废水中的重金属离子也能通过电解有所降低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,其装置示意图如图所示.

①若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入 ,a极的电极反应为 .
②能否用铜作电解重铬酸钠废水的电极? (填“能”或“不能”),理由是
③除去重铬酸根离子的离子反应是 .
-
I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术处理尾气,化学方程式为2NO + 2CO 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50× 10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答(均不考虑温度变化对催化效率的影响):
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的ΔH________0(填“>”、“<”或“=”)。
(2)前2s内的平均反应速度v (N2)=________。
(3)该温度下,反应的平衡常数K=________。
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如下图一所示。

(1)该电池正极的电极反应式为________。
(2)以上述电池为电源,构成图二电解池 ,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式________。
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸 )________ ________。
-
研究发现,反应CCl4(g)+H2(g) CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g) CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2 CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | α1 |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验(其他条件相同)。测得CCl4的消耗百分率(x%,实线)和生成物中CHCl3的百分含量(y%,虚线)随时间(t)的变化关系如图。
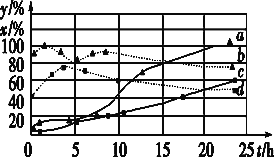
①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
-
研究发现,反应CCl4(g)+H2(g) CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g) CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2 CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | α1 |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验(其他条件相同)。测得CCl4的消耗百分率(x%,实线)和生成物中CHCl3的百分含量(y%,虚线)随时间(t)的变化关系如图。

①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
-
研究发现,反应CCl4(g)+H2(g) CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g) CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2 CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
| 实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | α1 |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验(其他条件相同)。测得CCl4的消耗百分率(x%,实线)和生成物中CHCl3的百分含量(y%,虚线)随时间(t)的变化关系如图。
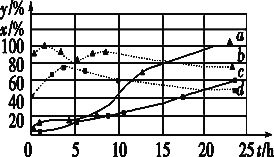
①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
-
氟利昂是饱和碳氢化合物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下(以二氯二氟甲烷为例,二氯二氟甲烷可由四氯化碳与氟化氢在催化剂存在下、控制回流冷凝温度为﹣5℃时得到):
①CF2Cl2 CF2Cl+Cl
CF2Cl+Cl
②Cl+O3→ClO+O2
③ClO+ClO→ClOOCl(过氧化氯)
④ClOOCl 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线使CF2Cl2分解产生的是臭氧生成氧气的催化剂
B. 反应③中的氯子与反应④中生成的氯原子化学性质相同
C. ClOOCl分子中各原子最外层均达到8电子稳定結构
D. 气态氢化物的稳定性:HF>H2O>HCl
-
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式:2NO+2CO  2CO2+N2;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2;为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/ mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应是________ 反应(填写“吸热”、“放热”)。
(2)前2s内的平均反应速度v(N2)=________。
(3)此反应的平衡常数表达式为K=________。
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
-
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO
 2CO2+N2.
2CO2+N2.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H______0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率υ(N2)=______.
(3)在该温度下,反应的平衡常数K=______.
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
实验
编号 | T(℃) | NO初始浓度
(mol/L) | CO初始浓度
(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | ______ | ______ | ______ | 124 |
| Ⅲ | 350 | ______ | ______ | 124 |
①请在上表空格中填入剩余的实验条件数据.
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.
-
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO
 2CO2+N2.
2CO2+N2.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H______0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率υ(N2)=______.
(3)在该温度下,反应的平衡常数K=______.
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
实验
编号 | T(℃) | NO初始浓度
(mol/L) | CO初始浓度
(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | ______ | ______ | ______ | 124 |
| Ⅲ | 350 | ______ | ______ | 124 |
①请在上表空格中填入剩余的实验条件数据.
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号.








