-
下列有关Na2CO3和NaHCO3性质的说法中,不正确的是( )
A. 热稳定性: Na2CO3>NaHCO3
B. 相同温度下,在水中Na2CO3的溶解度大于NaHCO3
C. Na2CO3和NaHCO3均可与澄清石灰水反应
D. 相同质量的Na2CO3和NaHCO3分别与过量盐酸反应,Na2CO3放出CO2多
难度: 中等查看答案及解析
-
下列除去杂质的方法不正确的是( )
A. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B. 用过量氨水除去Fe3+溶液中的少量Al3+
C. Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
D. MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
难度: 中等查看答案及解析
-
某溶液含有①NO3- ②HCO3- ③SO32- ④CO32- ⑤SO42- 等五种阴离子,向其中加入少量的过氧化钠固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积变化)( )
A.① B.①⑤ C.①④⑤ D.①③⑤
难度: 中等查看答案及解析
-
下列各组关于强电解质、弱电解质、非电解质的归类正确的( )
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H2CO3
Fe(OH)3
非电解质
蔗糖
BaSO4
C2H5OH
H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.向豆浆中加入盐卤可制作豆腐,利用了胶体聚沉的性质
难度: 中等查看答案及解析
-
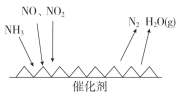
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
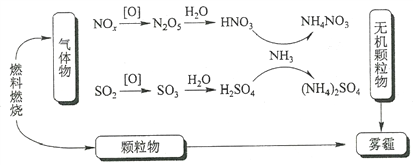
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
难度: 简单查看答案及解析
-
配制物质的量浓度为0.1 mol·L-1的Na2CO3溶液100 mL时,下列操作正确的是( )
A.用托盘天平称取1.06 g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B.在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
C.定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D.定容时,若仰视,则所配溶液的浓度将偏高
难度: 简单查看答案及解析
-
关于一些重要的化学概念有下列说法,其中正确的是( )
①Fe(OH)3胶体和CuSO4溶液都是混合物 ②BaSO4是一种难溶于水的强电解质 ③冰醋酸、纯碱、小苏打分别属于酸、碱、盐 ④煤的干馏、煤的气化和液化都属于化学变化 ⑤置换反应都属于离子反应
A.①②⑤ B.①②④ C.②③④ D.③④⑤
难度: 中等查看答案及解析
-
下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、淀粉
②含有氧元素的化合物叫氧化物
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物
④同素异形体:C60、C70、金刚石、石墨
⑤强电解质溶液的导电能力一定强
⑥在熔化状态下能导电的化合物为离子化合物
⑦有单质参加的反应或有单质生成的反应是氧化还原反应
A.全部正确 B.①②⑤⑦ C.②③⑥ D.④⑥
难度: 中等查看答案及解析
-
下列关于钠的描述中不正确的是( )
①自然界中的钠以单质和化合物的形式存在
②实验室剩余的钠需要放同原瓶
③钠的化学性质比较活泼,少量的钠可以保存在煤油中
④当钠与硫酸铜溶液反应时,有大量红色固体铜产生
⑤金属钠与O2反应,条件不同,产物不相同
⑥燃烧时放出白色火花,燃烧后生成浅黄色固体物质
⑦钠-钾合金通常状况下呈液态,可作原子反应堆的导热剂
A.①②④⑤⑥⑦ B.①④⑥ C.④⑤⑥ D.①⑥⑦
难度: 中等查看答案及解析
-
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
难度: 中等查看答案及解析
-
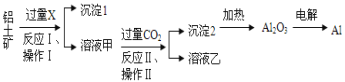
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
A.
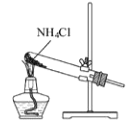 制取氨气 B.
制取氨气 B.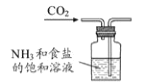 制取碳酸氢钠
制取碳酸氢钠C.
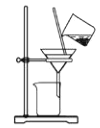 分离碳酸氢钠 D.
分离碳酸氢钠 D.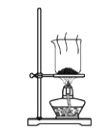 干燥碳酸氢钠
干燥碳酸氢钠难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,11.2 LHCl气体中含有的分子数为0.5NA
B.常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA
C.将0.2 mol FeCl3水解制成胶体,所得胶体粒子数为0.2NA
D.50 mL12 mol/L盐酸与足量MnO2共热,转移电子数为0.3NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )
A.能使石蕊显红色的溶液:K+、Mg2+、HCO3-、SO42-
B.水电离出来的 c(H+)=10-13mol·L-1的溶液:NH4+、Fe2+、NO3-、Cl-
C.c(H+)/c(OH-)=1012的溶液:K+、Fe3+ 、Cl-、SO42-
D.中性溶液中:Na+、SCN-、Fe3+、SO42-
难度: 中等查看答案及解析
-
下列化学实验事实及其解释正确的是
A.加热铝箱,铝并不滴落,说明铝具有很高的熔点
B.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O2再与水和二氧化碳反应
C.活性炭使红墨水褪色,是因为活性炭具有强氧化性
D.用胶头滴管向包有Na2O2的脱脂棉滴加几滴水,脱脂棉燃烧,说明H2O与Na2O2的反应是放热反应
难度: 中等查看答案及解析
-
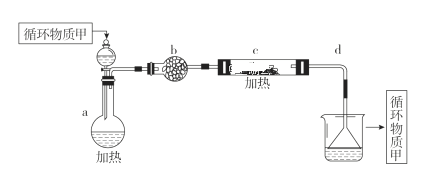
用下列装置不能达到有关实验目的的是
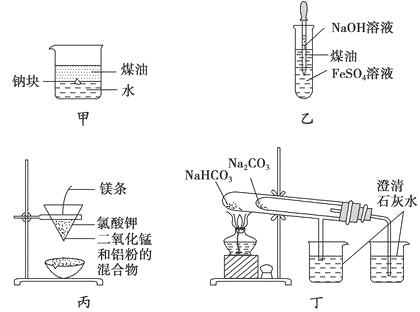
A.用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
B.用乙图装置制备Fe(OH)2
C.用丙图装置制取金属锰
D.用丁图装置比较NaHCO3和Na2CO3的热稳定性
难度: 中等查看答案及解析
-
下列鉴别碳酸钠和碳酸氢钠固体的方法中正确的是
A.分别取两种固体样品,加热产生气体的是碳酸钠
B.分别取样品溶于水后加入氯化钙溶液,若有白色沉淀则是碳酸氢钠
C.分别取样品溶于水后,通过加入氢氧化钠溶液后的现象来鉴别
D.分别取等质量的两种固体样品,与盐酸反应,产生气体较快的是碳酸氢钠
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol冰醋酸和lmol乙醇在加热和浓硫酸条件下充分反应生成的水分子数为NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.92.0 g甘油(丙三醇)中含有羟基数为1.0NA
D.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,124 g P4中所含P—P键数目为4NA
B.100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA
C.电解精炼铜时阳极减轻32g,电路中转移电子数目不一定为NA
D.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式不正确的是( )
A.钠与水反应:2Na+2H2O=2Na++2OH–+H2↑
B.向稀硝酸溶液中加入过量铁粉: Fe+NO3−+4H+=Fe3++NO↑+2H2O
C.向氢氧化钡溶液中加入稀硫酸: Ba2++2OH −+2H++SO42−=BaSO4↓+2H2O
D.泡沫灭火器反应原理:3HCO3−+Al3+=3CO2↑+Al(OH)3↓
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能够大量共存的是( )
A.在含有大量HCO3-的溶液中:Na+、NO3-、Cl-、Al3+
B.加铝粉放出大量H2的溶液中:K+、NH4+、SO42-、Br-
C.酸性条件下:Na+、NH4+、SO42-、NO3-
D.含0.1 mol/L NO3-的溶液中:H+、Fe2+、Mg2+、Cl-
难度: 中等查看答案及解析
-
正确表示下列反应的离子反应方程式为
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br﹣+3Cl2═2 Fe3++2 Br2+6Cl﹣
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:
C.
稀溶液与过量的KOH溶液反应:
D.醋酸除去水垢:
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①金属钠投入到FeCl2溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向饱和Na2CO3溶液中通入过量CO2.
A. ①②③④ B. ①④ C. ③④ D. ②③
难度: 中等查看答案及解析
-
将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
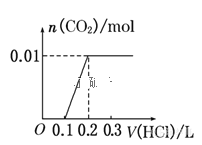 B.
B.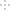
C.
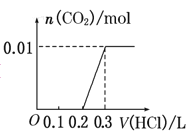 D.
D.
难度: 困难查看答案及解析
-
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
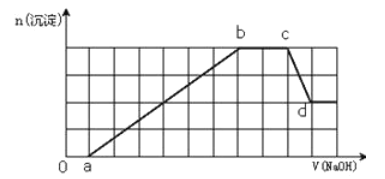
A.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B.ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
C.原溶液中含有的阳离子必定有H+、NH4+、Al3+但不能肯定Mg2+和Fe3+的中的哪一种
D.d点溶液中含有的溶质只有Na2SO4
难度: 中等查看答案及解析