-
下列不属于烧碱工业用途的是
A.制皂 B.造纸 C.精炼石油 D.制食盐
难度: 简单查看答案及解析
-
油酸的结构简式是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列颜色变化不符合事实的是
A.溴化银见光分解变白 B.湿润醋酸铅试纸遇硫化氢变黑
C.热的氧化铜遇乙醇变红 D.苯酚在空气中变粉红
难度: 中等查看答案及解析
-
稀有气体元素位于元素周期表第18列,则最外电子排布为4s24p1的元素位于元素周期表
A.第3列 B.第12列 C.第13列 D.第14列
难度: 简单查看答案及解析
-
科学家将石墨在氟磺酸中“溶解”制得石墨烯(即单层石墨),该溶解克服了石墨层与层之间的
A.范德华力 B.离子键 C.共价键 D.金属键
难度: 中等查看答案及解析
-
R分子的质量为a g,相对质量为M,则M与a的比值等于
A.6.02×1023 B.12C原子质量的十二分之一
C.0.012kg12C所含的原子数 D.1mol氧气所含的微粒数
难度: 中等查看答案及解析
-
生铁的熔点是1100~1200℃,则可推断纯铁的熔点是
A. 1085℃ B. 1160℃ C. 1200℃ D. 1535℃
难度: 简单查看答案及解析
-
将铜加入一定量稀硫酸和过氧化氢混合溶液中,充分反应后,溶液呈蓝色,有无色气体产生;若还发现容器底部有少量固体,则该固体可能是
A.Cu B.S C.CuS D.Cu2S
难度: 中等查看答案及解析
-
分子式为C7H8O的芳香族化合物不可能是( )
A.醇 B.酚 C.醚 D.醛
难度: 困难查看答案及解析
-
实验室保存以下药品,宜用棕色、细口、配有磨口塞玻璃瓶的是
A.浓硝酸 B.氢氟酸 C.氢氧化钠溶液 D.硝酸银固体
难度: 中等查看答案及解析
-
根据表中键能(kJ/mol)数据不能得出的结论是
共价键
键能
H-H
436
H-F
565
H-S
339
H-Se
314
A.H2(g)→2H (g)-436kJ
B.H(g)+F(g)→HF (g)+565kJ
C.HF的热稳定性大于H2S
D.H2S的沸点比H2Se的沸点高
难度: 中等查看答案及解析
-
用有阳离子交换膜(只允许阳离子通过)的电解槽电解食盐水时,以下叙述错误的是
A.用铁作阴极 B.用碳棒作正极
C.食盐水从阳极区加入 D.烧碱溶液从阴极区流出
难度: 中等查看答案及解析
-
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为
A.1︰1︰1 B.2︰2︰1 C.2︰3︰1 D.4︰3︰2
难度: 中等查看答案及解析
-
关于35℃的0.1mol/L NaOH溶液,以下表述错误的是
A.Kw>1×10-14 B.水电离的c(H+)>1×10-13 mol/L
C.pH>13 D.c(OH-) = c(H+) + c(Na+)
难度: 中等查看答案及解析
-
以下验证元素的金属性、非金属性强弱的实验,所用物品不合理的是
A.比较钾、钠:Na、K、H2O
B.比较镁、铝:MgCl2溶液、AlCl3溶液、 NaOH溶液
C.比较硫、氯:Na2S溶液、NaCl溶液、pH试纸
D.比较溴、碘:溴水、KI淀粉试纸
难度: 中等查看答案及解析
-
某乙醛中混有少量乙醇,要分析该乙醛的纯度,取样,进行以下定量分析,其中不合理的是
A.测定蒸气的摩尔体积 B.与银氨溶液反应,分析产生银的量
C.与钠反应,分析产生氢气的量 D.用酸性高锰酸钾溶液滴定,分析相关数据
难度: 中等查看答案及解析
-
过氧化氢分子中含有过氧键(-O-O-)。有机化合物A的相对分子质量为120。经分析,其中氧的质量分数为0.5334,其余为碳和氢,则A分子中过氧键数最多为
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
NH3与Cl2反应的产物不可能是
A.N2、HCl B.NH4Cl、H2
C.N2、NH4Cl D.N2、HCl、NH4Cl
难度: 简单查看答案及解析
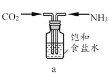
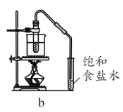
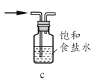

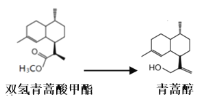
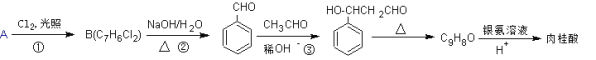
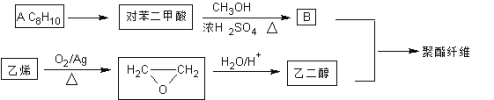
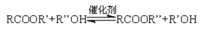
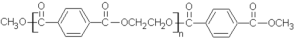 ,若乙二醇过量,则生成的聚酯纤维可表示为_______________________________。
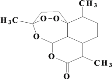
,若乙二醇过量,则生成的聚酯纤维可表示为_______________________________。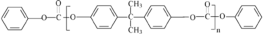 ,合成PC的2种单体中:醇(或酚)的结构简式为______________________,酯的名称为
,合成PC的2种单体中:醇(或酚)的结构简式为______________________,酯的名称为